 |
 |
 |
 |
1 ... 19 20 21 22 23 24 25 ... 49 5) М. м. в ватном производстве. Мойку ваты производят на промывной овально ймойк е. См. Ватное производство, фиг. 5. МОЖЖЕВЕЛЬНИК, название группы деревьев и кустарников с ароматическим запахом, произрастающих в количестве до 30 видов в северном полушарии. Главнейшие виды М. следующие. Обыкновенный М. (Juniperus communis)-небольшой кустарник, реже дерево до 12 м высотою, произрастающее во всей Европе и Сибири; обладает пахучей твердой и трудно раско-лимой древесиной с желтоватой оболонью и желто-бурым ядром; об. вес 0,62; употребляется на мелкие поделки, хорошо полируется. Кедровый вереск, красный кедр (Juniperus oxycedrus)-кустарник или деревцо до 3 jh высотою; произрастает в Крыму, на черноморском побережьи Кавказа, а также в средиземноморской области 3. Европы. Древесина плотная, об. вес 0,05-0,75 (в воздушносухом состоянии), душистая и смолистая с светлорозовым ядром, употребляется для карандашей, различных мелких столярных поделок, на виноградные тычины иир. Гималайский М., древовидный можже-ве. льно-гималайский кедр (Juniperus excelsa)-растет дико в Крыму и на Кавказе, в М. Азии и Персии; достигает высоты до 8-9 ж при диам. около 1 м. Плотная, прочная, ароматическая, красивого розового цвета древесина его употребляется для карандашей, на мелкие поделки и виноградные тычины. Древесина М., будучи пропитана смолою, противостоит гниению и червоточине. Виргинский М. (J. virginiana) - обычно невысокое дерево, но иногда достигает высоты до 24 ж; произрастает в США (на территории от Гудзо-нова залива до Мексиканского залива и от Н. Брауншвейга до Флориды и Скалистых гор). Разводится также искусственно в Европе (с 1664 г.). Древесина его красно-бурого цвета, известна под названием красного кипариса (Red Cedar), легкая, об. вес ее 0,33, прочная, легко строгается, идет на карандаши. Эта весьма ценная порода для полиграфич. производства м. б. разводима и у нас; встречается у нас в парках и садах, а также в культурах на юге СССР. Из других ценных М., произрастающих в СССР в Ср. Азии, Сибири и на Гималайских горах, следует упомянуть арчу (J. pseudosabina), древесина к-рой тоже пригодна для карандашного производства. Остальные М. представляют собой не имеющие особого значения низкорослые кустарники. Из смолы М. добывается сандарак (см.). Ягоды применяются в медицине; после сбра-Ж1шания ягоды дают можжевеловую водку; в нек-рых местах из ягод варят особое пиво, добывают из них также эфирное можжевеловое масло (с выходом до 1-1,5 %). В состав масла входит: а-пинен, камфен- терпинеол, терпеновый спирт неизвестного строения, кадинен и другие сссквитерпены. Нормальное можжевеловое масло должно иметь следующие константы: уд. вес 0,867- 0,882, вращение aj) от-1° до-13°, коэфициент преломления 1,472-1,484, кислотное число до 3, эфирное число 1,0-12, эфирное число после ацетилирования 19-31. Производство его в СССР развито по преимуществу в сев. и сев .-вост. районах и отчасти обслуживает экспорт. Иногда из ягод изготовляют краску, а кору М. употребляют как дубильный материал (см. Спр. ТЭ, т. III). Лит.: Керн Э., Деревья и кустарники, их лесоводственные особенности, использование и технич. применения, М.-Л., 19 25; Пеньковский В., Деревья и кустарники как разводимые, так и дикорастущие в Европейской России, на Кавказе и в Сибири, Херсон, 1901; В ольф Э., Хвойные деревья и кустарники Европейской и Азиатской частей СССР, Л., 1925. Н. Кобранов. МОЗАИЧНЫЙ НАБОР, см. Набор типографский. МОЙКА-ПРОМЫВКА, одна из валшейших мокрых операций при облагоралшвании текстильных во.токон, обработка непряденого волокна, или пряжи, и.чи ткани водой в моющей ванне, сопровождающаяся механическими воздействиями-разбалтывашгем,. отжимом и т. д. (в некоторых случаях применяют слабые растворы моющих веществ- соды, контакта Тит. д.). М.-п. имеет целью очистку волокон от примесей и загрязнений случайного характера (например грязи), естественного характера (например шерстяного, пота), намеренно нанесенных на волокно (шлихты), и окончательное освобождение волокна от незакрепленного красителя, использованных химич. материалов, загустки и мыла после крашения, печати и мыловки. Хорошая промывка товара нужна не только для улучшения внешнего вида волокнистых материалов, но и для придания им большей прочности, так как при помощи ее удаляются химич. вещества, разрушающие волокна (кислота-хлопок, щелочь-шерсть, шелк). При промывке б. ч. пользуются холодной водой и только в редких случаях теплой. Чистота воды имеет важное значение при М.-п.: вода, загрязненная механическими примесями, при мойке фильтруется через товар и не промывает, а грязнит его; поэтому для мойки следует применять воду или фильтрованную или же пропущенную через отстойники; также весьма нецелесообразно при М.-п. пользоваться жесткой водой, и во всяком случае исключается применение железистой воды. М.-п. производят в специальных моечных машинах разнообразных конструкций, а также в аппаратах для крашения и проходных аппаратах. Для непряденого волокна применяют моечные машины овальной формы с крыльчатыми или вильчатыми мешалками, а также левиафаны (см. Промывные машины). Пряжу промывают в неподвижном состоянии-в бассейнах с циркуляцией, а при движении-в различных нолоскально-моечных машинах; для хлопковой ткани наиболее употребительна машина к л а п о, в к-рой происходит попеременное отжатие товара и смачивание. Другие машины для той же цели производят встряхивание, чем усиливается промывка, и наконец т. н. по-лоскалки промывают кусковой товар без натяжения. Ящики проходных аппаратов, предназначенные для промывки, снабжены особыми трубами с мелкими отверстиями, из к-рых вода опрыскивает ткань, что способствует обильному промыванию ее насквозь. Лит.: Шапошников В. Г., Общая технология волокнистых и красящих веществ, М.-Киев, 1926; Н а 1 1 е г R., Chemische Technologie d. Baum-wolle, Technologie d. Textilfasern, hrsg. v. R. Herzog, B. 4, T. 3, в., 1928; G 1 a f e у H., Hllfsmittel zur Ver-edlung d. Baumwolltextilien, ibid. B. Абоаин. МОЙКА ШЕРСТИ, см. Шерсть. МОЛ, инженерное сооружение, возводимое в море и представляюшее собой массивную, прочную стенку, примыкающую одним  Фйг, 1. концом к берегу, в отличие от волнолома (см.), связи с берегом не имеющего. Назначение мола - образование водной портовой площади, защита ее от волнения и использование в отдельных случаях мола как причала для судов. Конец мола., выступающий в море, назьшается г^о л о в о й, примыкающий к берегу-к о р и е м М. Размеры и конструкция М. определяются силой и направлением ветров и волнения, глубиной заложения М., свойствами дна и материалов, из к-рых М. сооружен, а для замерзающих морей также и напором льда. По форме М. бывают с пологими или вертикальными откосами, а по роду материалов-каменные, -e.io киижвоЗ*  Фиг. 2. бетонные, железобетонные, деревянные, смешанной конструкции и фашинные. Основным материалом, применяемым для постройки М., является камень в естественном виде или же в виде искусственных массивов, как наиболее удовлетворяющий предъявляемым к материалам, идущим для М., требованиям: плотности, достаточным размерам и химич. неизменяемости под действием морской воды, а также дешевизне и широкому распространению. Как всякое сооружение мол должен рассчитываться на прочность в отдельных частях его, на сдвиг и опрокидывание. Вследствие Недостаточной определенности воздействия волн на М., при расчетах берут коэфициенты запаса прочности не ме-  Фиг. 3. нее 2-2,5. Наиболее подвержены действию волн голова и корень М., а также и подошва, почему эти части требуют особенно тщательного устройства, в виду громадного давления волн на сооружение (30-40 т/лг) и явления подмыва дна. Различные условия сооружения М. приводят к следующим типам их. 1) Обычное применение естественного камня в виде наброски придает М. очертания, приведенные' на фиг. 1 (Панамский М.) и фиг. 2 (американский М.). Поперечное сечение таких молов характеризуется различными откосами со стороны моря (от 1 : 1,5 до 1 :16) и со стороны .гавани (от 1 :1 до 1 : 2), тщательной сортировкой камней по размеру и значительной шириной поверху и в основании. Материалом .служит рваный или булыжный камень весом от 80 кг до 1,5-2,0 т. На случай особенно сильного волнения верхнюю часть мола обкладывают искусственными массивами объемом до 30-35 м^ для предохранения сооружения от размыва. Типичным примером такой конструкции является Марсельский М. (фиг. 3). Дальнейшим развитием этого типа является укладка массивов на откосе не в виде наброски, а путем  Фиг. 4. правильной укладки их в один, два ряда и с более крутым откосом. 2) При отсутствии на месте крупных каменных залежей! и; ради скорейшего выполнения работ применяются искусственные массивы в виде наброски , примером чего служит мол в Поти (фиг. 4). М. из наброски естественных или искусственных камней и массивов имеют помимо меньшей стоимости и простоты выполнения преимущество перед другими типами, заключающееся в том, что осадка сооружения в целом или в отдельных частях не влечет за собою вредных последствий. 3) При наличии хорошего грунта в основа-  нии М. часто делаются в виде стенки с вертикальными или очень крутыми откосами, сложенной из правильной массивной кладки. Массивы достигают размеров 30-40 м^ и укладываются при помощи специальных кранов насухо с перевязкой швов, горизонтальными рядами. На фиг. 5 показано поперечное сечение Новороссийского мола. Для лучшего обеспечения сооружения от повреждений при различной осадке основания, к чему этот тип М. весьма чувствителен, кладку массивов иногда производят наклонными рядами под углом 60-80°. Такая кладка (фиг. 6) производилась при постройке М. в Ляраше (Larrasch). Подобное расположение слоев представляет преиму- щества по сравпению с кладкой горизонтальными слоями: отдельные ряды могут свободно сползать один по другому, что при неравномерной осадке основания не нарушает монолитности сооружений; кроме того отдельные массивы оказываются прижатыми  ФПГ. 6. друг к другу не только по плоскостям между слоями, но также и в швах между массивами одного и того же слоя. 4) В целях уменьшения количества материалов сооружаются т. наз. свайные М.,в которых наружные грани обделываются сплошными свайными рядами, а середина сооружения, составленная из отдельных свай, заполняется камнем, песком или фашинными тюфяками (фиг. 7). Тип этот применим при небольших (до 7 м) глубинах и лишь в морях, где нет морского червя, разрушающего дерево. Деревянные сваи, образующие стенки этих М., м. б. заменены железобетонными, и тогда сооружение приобретает большую надежность, но стоимость в этом случае значительно возрастает. 5) В тех случаях, когда забивка свай затруднительна, оболочкой каменного заполнения мола служат деревянные срубы, образующие так наз. ряжевые молы. Такие срубы, размером до 7,5x10x20 jh, из бревен или пластин рубят на берегу, спускают на воду и на плаву подводят к месту установки, где по- -*2.7S------------4.30 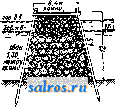 Фиг. 7. 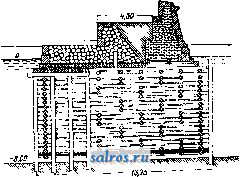 Фиг. 8. средством заполнения камнем погружают на дно, на подготовленную каменную подсыпку толщиной от 1,0 до 1,75 м или непосредственно на грунт основания. Внутри ряжи разбиты продольными и поперечными сквоз- ными стенками на отдельные отсеки, внизу же на уровне третьего венца врубается пол, удерживающий каменную засыпку (фиг. 8). В этом примере в части ряжа, обращенной к гавани, забиты сваи для предохранения ряжа от сдвига. 6) Предыдущий тип ряжевых М. в своем развитии привел к получившему в настоящее время повсеместное применение типу М. из гигантских массивов. В этом случае ряжи заменяются железобетонными ящиками размером до 10-12 м в ширину и высоту и до 30 м в длину, заполняемыми после установки на место тощим бетоном или песком. Сами ящики внутри делятся наподобие ряжей на отсеки и подводятся к месту на плаву. После затвердения бетопа внутри ящиков получаются дюнолитные массивы весом до 8 ООО-9 ООО т, что дает сооружению болыпую надежность при простоте выполнения. Метод создания оградительных сооружений из массивов-гигантов (фиг. 9), очень удобный в смысле производства работ, получил в последние годы применение в разных странах (в Голландии, Франции, Африке и в Южной Америке), а также в СССР, где из них возведены М. и волнолом в Туапсе. Помимо вышеуказанных типов М. встре- --)5,25- -   Фиг. 9. чаются и другие, являющиеся смешанными конструкциями и имеющие местное значение. Расчет мола как инженерного сооруж;е-ния является весьма сложным вследствие неопределенности воздействия на них внешних усилий, и история их существования дает примеры многочисленных разрушений и повреждений. Стоимость же мола весьма различна в зависимости от глубины заложения, конструкции и условий производства работ. Лит.: Корчинский Л., Молы, 1915; Л я х-ницкий В. е.. Курс морских и речных портов, М.-Д., 1926; Нюберг А. Г., Курс портовых сооружений, ч. 1-2, СПБ, 1893; Кандиба Б. Н., Об устройстве внешних оградительных сооружений из искусственных массивов, СПБ, 1901; S с h и 11 z е F.,Seehafenbau, В. 1-2, В., 1911-13; М о е 1 1 е г М., Grundrisse d. Wasserbaues, В. 1-2, Lpz., 1906; В 6-n 6 z i t M., Cours de ports et travaux maritimes, t. 1- 3, P., 1921-23; Qulnette de Rochemont, Cours de travaux maritimes, t. 1-2, P., 1901; Cunningham в.. The Dock a. Harbour Engineers Reference Book. 2 edition, Loudon, 192a; The Welland Ship Canal, XV, Engineering , London, 1930, v. 80, p. 637. B. Медведев. МОЛЕКУЛА, минимальная частица вещества, способная к самостоятельному существованию при д 1ННЫХ условиях темп-ры и давления и обладающая основными химическими сЕОйствами, присущими данному веществу в бол1Шом количестве. Свойства тела обусловлены свойствами и расположением его молекул. Физич^ ски М. представляет собою агрегат атомов большей или меньшей степени сложности, от простейших одноатомных М., какими являются М. благородных газов (см.) и М. большинства ме- таллов (в состоянии пара), двух-, трехатомных (М. большинства простых газов) и до более сложных М., содержащих десятки и сотни атомов (М. орган, в; ществ). Обычно различают М. гомеополярные, или атомные, и гетерополярные, или и о н н ы е, Первые построены из электрически нейтральных атомов, вторые-из ионов (см.),т. е. заряясзнных атомов или групп атомов (радикалов). Вещ'ства, состоящие из атомных М., отличаются отсутствием электролитич. проводимости, малой диэлектрической постоянной, заметной летучестью и т. д. Характерным признаком ионных М. являются, наоборот, электролитич. диссоциация соответствующих веществ в жидком состоянии или в растворе, большая диэлектрич. постоянная, склонность к образованию молекулярных комплексов-ассог^г<агш£(см.). Элемг!нтами кристаллических р( шеток этих веществ являются ионы. Гомеополярными веществами являются большинство газов, напр. На, Оа, Na, и ббльшая часть органич. соединений. Гетерополярны большинство к-т и их солей, в особенности галоидные соли Щ|лочных элементов, а также вода, аммиак и т. д. Однако разделение веществ на гомео- и гетерополярные не всегда м. б. строго проведено. Целый ряд веществ помещается М'жду этими классами, по одним признакам примыкая к гомеополярным веществам и по другим-к гетерополярным. Внутреннее строение М. в основном напоминает строение атомов. Главной особенностью М. является наличие двух или нескольких ядер (если не рассматривать одно-атомные М.). Благодаря этой особенности М. приобретает ряд новых свойств, отличных от свойств, присущих атому. На основании модельных представление, развитых в теории строения атома (см. Атомная теория), можно трактовать всякую М. как некоторую пространственную конфигурацию положительно заряженных ядер, окруженных отрицательными зарядами-электронами. В атомных М. электроны располагаются симметрично относительно всех ядер. Асимметричное распределение электронов в ионной молекуле приводит к тому, что различные части ее получают противоположные заряды и М. оказывается полярной. При образовании М.из атомов происходит перераспределение атомных электронов соответственно новому образованию-молекуле. В этом перераспределении принимают участие только внешние, или валентные, электроны атомов, ко орые образуют внешнюю электронную оболочку М., определяющую ббльшую часть ее свойств и прежде вс( го оптич., химич. и электрич. свойства. Структура внешней электронной оболочки М. в основном аналогична структуре оболочек атомов. Этим и объясняется тот факт, что многие М. во многих отношениях аналогичны соответствующим атомам. Так, молекула СО аналогична Mg (ср. соединения COg и MgO, и т. д.), молекула CN аналогична атому С1 (соединения CgNa и Cla, HCN и НС1); способность органич. радикалов замещать cootbi тствую-щие атомы также свидетельствует об аналогичной структуре их электронных оболочек. Количественный расчет той электрической  системы, которую мы называем М., представляет однако пока непреодолимые математич, затруднения. Лишь в случае простейших М. оказалось возможным решение задачи, и то в первом приближении. На помещенной диаграмм; приводится результат это* го ргш ния для случая М. водорода. Здесь на оси абсцисс отложено расстояние г мг жду ядрами водорода, а на оси ординат-потенциальная энергия Е молекулы (в V). Нижняя кривая, обладающая минимумом энергии, отвечает устойчивому образованию, т. е. нормальной М. На, верхняя же кривая соответствует упругому столкновению атомов (Е > 0), Заметим, что подобные расчеты основаны на методах, развитых в волновой механике, и только благодаря последней ста- gor ли возможными. Впрочем это не относится к ионным М., представляющим в отношннии их матема- ;, тич. расчета значитель- ные преимущества, пoc- кольку главная часть их \ энергии обусловлена ку-лоновским притяжением образующих их ионов. В случае простейших М.- двухатомных-зд( сь оказалось возможным вычислить целый ряд молекулярных констант (см. ниже); в случае же более сложных М. удалось установить их размеры и форму. Так, в М. воды HgO ионы Н*, Н и О располагаются в вершинах равнобедренного тр-ка, а в ионе СОд углеродный ион С ** помещается на перпендикуляре, восставленном из центра правильного тр-хса, в вершинах к-рого сидят ионы О , и т. д. В непосредственной связи со степенью асимметрии электронной оболочки М. стоит склонность М. к образованию б, или м. сложных молекулярных комплексов (ассоциация и комплексообразование). Степень асимметрии М. количественно характеризуется дипольным моментом (см. Диполь молекул я пный). Полярные М., отличающиеся большим дипольн. моментом, взаимодействуют как магнитики. Поэтому именно этот класс М. должен обладать наибольшей склонностью к ассоциации (и вообще к комплексообразованию). Действительно известно, что такие bi Щ( ства, как вода, спирты, кислоты и т, д., принадлежат к классу сильно ассоциирующихся в(Щ.ств. Эта ассоциация проявляется в отклонении от газовых законов, от правила Трутона, в сильной адсорбируемости-поверхностной активности (см. Капиллярные явления. Адсорбция). Громадное значение для ассоциации и комплексообразования имеет поляризация (или деформация) электронных обо л 04 к молекул, им( ющая место при их сближении. Возникающий в результате поляризации индуцированный электрический момент и способствует ассоциации. Поляризация особенно сильна в случае ионов, к-рые при нормальном давлении газа или в растворах являются сложными комплексами, возникшими в результате притяжения ионом им же поляризованных окружающих его М, Энергия, связанная с поля- ризационными силами и с силами взаимодействия диполей, составляет обычно несколько тысяч cal на моль. Эта энергия имеет следовательно тот же порядок величины, что и теплота испарения. Это показывает, что силы, связывающие молекулы данного вещества в твердом и жидком состоянии, имеют одинаковое нроисхождение с силами, которые обусловливают ассоциацию. Сказанное однако имеет место лишь в случае веществ, кристаллизующихся в молекулярные решетки. В случае же веществ, образующих ионные кристаллические решетки, силы взаимодействия между конденсированными М. настолько велики, что М. теряют свою индивидуальность. В связи с этим теплота испарения и сублимации таких веществ значительно превышает теплоту ассоциации и выражается десятками тысяч cal на моль. Таковы напр. галоидные соли щелочных элементов. Наряду с асимметрией весьма существенное значение для образования молекулярных соединений имеет степень замкнутости электронной оболочки М. Эта замкнутость осуществляется тем, что образующие внешнюю оболочку М., электроны группируются попарно, образуя замкнутые астатические системы (ряд фактов заставляет приписать электрону магнитный момент), не принимающие участия в валентной связи. Именно отсутствием замкнутости электронной оболочки М. объясняется тот факт, что все М. с нечетным числом электронов (т. наз. нечетные М.) являются химически ненасыщенными и особенно склонны к ассоциации. Таковыми являются М.: NOg, ассоциирующиеся в (N02)2; CN, существующие в обычных условиях в виде М. (CN)2, HgCl-HgaCla, Na-Nag и т. д. В связи с незамкнутостью электронной оболочки М. Оа, Sa, Ргит. д. СТОИТ и факт существования М. Os, О4, S Sg, Р4 и т. д. Впрочем М., ассоциированные вследствие незамкнутости электронных оболочек (N2O4, CgNg, Р4 И т. д.), должны быть скорее рассматриваемы как обыкновенные химич. соединения (характеризующиеся определенными стехиометрич. соотношениями); однако часто очень трудно провести грань между молекулярным и обычным соединением. Особенно разительный пример такой неоиределенности имеем в М. О4, теплота диссоциации к-рой на 2 Og составляет всего 130 са! на моль. Одним из главных свойств М., отличающих ее от атома, является наличие (наряду с поступательным движением М. как целого) вращательного движения М. и колебательного движения ее частей. Колебательное и вращательное движение М. проявляется прежде всего в теплоемкости (см.) последней. Теплоемкость многоатомных газов всегда больше теплоемкости одноатомных, так как при нагревании первых нек-рая дополнительная часть энергии идет на возбуждение колебания и вращения. Согласно теории квантов на каждую степень свободы этих родов движения приходится количество энергии W (отнесенное к молю), равное 1 Nohv где V - частота колебаний (оборотов) вращающейся М., Т-абс. температура, R- газовая постоянная, -число Авогадро и h-постоянная Планка, равная 6,55-10 эрг/ск. при малых значениях v (1) переходит в I RT. Так как частоты вращения М. как правило малы, то величина I RT с достаточной точностью может выражать соответствующую часть вращательной энергии М. Доля теплоемкости, отвечающая (1) или более простому выражению RT, получается диференцированием по Т. Что касается числа степеней свободы, то оно для вращательного движения равно числу i осей, вокруг к-рых М. может вращаться, и для колебательного- числу j частот собственных колебаний М. Т. о. для молярной теплоемкости (при постоянном объеме) получается следующее выражение: Nohvj Во (2) обозначает одну из частот собственных колебаний М. Заметим, что для двухатомной М. г = 2 и J = 1. Другой областью, где проявляются внутренние движения М., является область молекулярной спектроскопии. Благодаря наличию колебаний и вращения М. спектры последних (линейчато-поло-сатые) представляются значительно более сложными, чем сравнительно простые (линейчатые) спектры атомов. Анализ линей-чато-полосатых молекулярных спектров позволяет с большой точностью определить такие важные величины, как частоты собственных колебаний v, момент инерции I и теплоту диссоциации молекулы D. Две первых величины входят в химическую константу М. Кроме этих величин константами, характеризующими каждую данную М., можно считать ее диаметр (размеры), расстояние г между атомами в М., углы, определяющие форму М. и электрич. момент р М. Диаметр М. определяется из коэф-тов внутреннего трения или диффузии (газы), при помощи рентгеновского анализа (твердые тела) или из тонких мономолекулярных пленок на поверхности жидкостей, и имеет значения, колеблющиеся для разных веществ в пределах от 2 до 10 А. Диаметр, большинства М. неорганических веществ выражается числом, близким к 3 А. Расстояние между атомами или отдельными группами атомов М. с большой степенью точности вычисляется из моментов инерции, определяемых оптич. путем, или из рентгенографических исследований. Так, для расстояния между атомами Н в М. HgO получается число 1,09 А, а для расстояния между атомами О и Н-0,87 А. В М. СО а для расстояния между атомами О получается число 1,95 А, а для расстояния между атомами С и О-Ю,96 А, почти ровно вдвое меньше. На основании этих чисел заключают, что М. НаО имеет форму тр-ка со сторонами 1,09 и 0,87 А (две одинаковые стороны, ср. выше), а в М. СО а все три атома располагаются почти точно на одной прямой. Повидимому в связи с этим обстоятельством находится ничтожно малый электрич. момент М. СО2- Аналогичные исследования внутримолекулярных расстояний в случае сложных органич. М. показывают, что атомы С здесь нередко располагаются на зигзагообразной линии, сохраняющей постоянные углы. Одним из методов определения электретеского момента М. является метод, основанный на изучении зависимости диэлектрической постоянной от t°. Электрич. моменты /и большинства полярных молекул имеют значения, близкие к 1-10~ абсолютных электростатич. единиц, достигая однако в случае особенно асимметричных молекул величины от 4 10 до 6 10-18 [CeHgNOa, CeH,(NOa)a, CH3C6H2(NOa)3] и падая до нуля в случае симметричных М. Влияние асимметрии М. на ее дипольный момент ясно обнаруживается при последовательном замещении хлором атомов водорода в метане(СН4),что видно из следующего: Молекула . . . СН* CH3CI CHaCU CHCls CCI4 10~i8 .... О 1,97 1,59 0,95 О Лит.: Кондратьев В. Н., Семенов Н. Н. иХаритонЮ. В., Электронная химия, М,-Л., 1927; Кондратьев В. Н., Физич. и химич. свойства молекул, М.-Л., 1928; Лондон Ф., Теория квантов и химич. связь, УФН , 1929, 9, вып. 2, стр. 167; Lewis G., Valence а. the Structure of Atoms a. Molecules, N. Y., 1925; M e с It e R., Bandenspeittra u. ihre Bedeutung f. die Chemie, В., 1929; D e b у e P., Polar Molecules, N. Y., 1929. B. Кондратьев. МОЛЕКУЛЯРНЫЕ РЕАКЦИИ, см. Реакции химические. МОЛЕКУЛЯРНЫЙ ВЕС, относительная масса (вес) молекулы данного вещества (см. Молекула) по отношению к массе атома кислорода, принятой за 16,000. При этом М. в. водорода-относительная масса наиболее легкой молекулы-2,016. Понятие М. в. можно обобщить, распространив его на любую частицу, способную существовать отдельно; совокупность таких частиц характеризует физико-химическое состояние вещества. Так, многие вещества в жидком состоянии содержат двойные, тройные и т. д. (ассоциированные) молекулы (см. Жидкости). Такие же ассоциированные молекулы содержатся иногда и в парах. Отдельные частицы-мицеллы-в коллоидных растворах являются агрегатами, состоящими из большого числа, молекул. Простейшими молекулами данного вещества являются при этом наименьшие из возможных составляющих его частиц, отвечающие его наиболее простой структурной ф-ле; наличие этих простейших молекул обнаруживается одним из методов определения М. в. (см. ниже), иногда при специа.т1ьно выбранных физич. условиях (напр. при высокой t°). Простейшие молекулы простых веществ одноатомны; тайовы напр. молекулы металлов в парообразном состоянии и благородных тазов. Молекулы других простых веществ, газообразных при обычных условиях, б. ч. двухатомны (Hg, О2, N3, Clg), но при высоких 1° диссоциируют на одноатомные. Реальные тела (жидкости, пары) следует рассматривать как систему из нескольких видов молекул, находящихся мея-сду собою в подвижном равновесии (см. Равновесие ф л зико-химическое). Методы определения М.в. можно разделить на суммарные, к-рые дают М. в. тела, т. е. средний вес отдельных образующих TevTO частиц (часто различных), и элементарные, дающие М.в. каждого вида частиц, содержащихся в теле. Только элементарные методы дают колич. представление о характере различи, частиц, образующих тело. В физико-химич. практике наиболее распространены суммарные методы определения М. в.; они вполне достаточны для тех случаев, когда тело практически содержит молекулы только одного вида; нек-рые из этих методов отличаются высокой точностью, позволяющей определять из полученных данных и точные атомные веса (физич. методы определения ат. в.). К суммарным методам относятся: 1) методы определения М. в. в газообразном (парообразном) состоянии, основанные на законе Авогадро (см. Газ); 2) осмотич. методы, дающие М. в. растворенных веществ и основанные на термо-динамич. законах учения о разбавленных растворах; 3) кинетич. методы определения М. в.; к ним относятся измерения скорости истечения газов (т. н. эффузии), определение коэф-та диффузии (см. Диффузия) и метод ультрацентрифугирования, имеющий особенно большое значение для тяжелых молекул и коллоидных частиц; 4) определение среднего М. в. жидкости по изменению поверхностного натяяения с Г (см. Поверхностное натяжение. Капиллярные явления, Жидкости). 1. Зная плотность пара вещества по отношению к водороду (Djj) или к воздуху (Db) при данных условиях (t°, р) и считая пар идеальным газом, находим его М. в. (М) по формуле: М = 2,016Х>я (или М = 2Ds). (1) Т. к. плотность воздуха по отношению к водороду = 14,4, то М = 28,дЪВв (или М^29ВвУ, (2) зная число Авогадро N=6,06-10 (число молекул в 1 г-мол.), находим абсолютную массу молекулы в г: * N 6,06 1023 Из основной постоянной закона Авогадро- нормального молярного объема идеального газа г> ,= 22,416 л/г-мол. (см. Газ) можно найти М. в., измерив объем v, занимаемый данной произво.тьной массой газа (пара) Р при нормальных условиях: 22,4 Р; = д-вес 1 л газа при нормальных условиях. Т. к. условия идеальности газа или пара удовлетворяются далеко не строго, то ф-лы (1), (2), (3) дают, вообще говоря, только грубо приближенный М. в.; однако в большинстве случаев это оказывается достаточным, т. к. точный М. в. вычисляется затем по химич. формуле; предварительное же физическое определение необходимо чтобы решить, соответствует ли молекуле простейшая или кратная (двойная, тройная и т. д.) ф-ла. В случаях весьма точных измерений М. в. газов, напр. когда ими пользуются для определения основных ат. в. (О, N, И и др.- работы Гюи, Ледюка, Мор лея и др.),-во все ф-лы вводятся поправки на уклонение газа от идеально-газовых законов; например вместо ф-лы (3) получаем: М 22,416 1 + Я 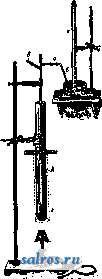 (т. к. 22,416 л данного реального газа содержат при нормальных условиях не 1, а 1 + Я г-мол.; поправка А определяется из уклонений от идеально-газовых законов). Т. о. определение М. в. паров сводится к решению газометрической -. задачи и осуществляется одним из следующих способов (при t = Const): а) Р определяется взвешивани-,ем данного объема пара v под данным давлением р (метод Дюма, точное определение веса 1 л газа при нормальных условиях), б) Даны р, Р, определяется V-наиболее общепринятый метод определения плотности паров В. Мейе-ра; V измеряется по объему вытесненного воздуха, см. фиг. Главную часть прибора составляет стеклянный сосуд А, имеющий вверху отверстие для введения ампулы с испытуемым веществом, газоотводную трубку аб и при-способ.тение в для опускания ампулы на дно сосуда (стеклянная палочка, укрепленная подвижно); нижняя часть сосуда окружена обогревательной оболочкой г. Навеска испытуемого вещества в ампуле помещается на палочку; сосуд А нагревают до постоянной 1°, после чего выдвиганием палочки заставляют ампулу упасть на дно сосуда, где она разбивается ! Вещество, испаряясь, вытесняет равный объем воздуха через трубку б в сосуд е, где его и измеряют, в) Даны г;, Р, определяется р (метод Гей-Люссака-Гофмана); для этой цели очень удобен прибор Блек-мана, в к-ром в стеклянную трубку с навеской данного вещества запаивается градуированный капилляр, закрытый с одного конца находящимся в нем ртутным столбиком. При помещении трубки в термостат вешество переходит в пар при данной t°, ж давление, производимое им, легко вычисляется прямо по перемещению ртутного столбика в капилляре, т. е. по сжатию объема воздуха, заключенного в капилляре. 2. Осмотические методы основаны на том, что, как показывает термодинамич. теория растворов, понижение t°game. и повышение в слабых растворах пропорциональны концентрации, т. е. числу отдельных частиц (молекул, ионов) в единице объема; при расчете на 1 молекулу (т. е. 1 г-мол.) они не зависят от природы растворенного вещества и характерны для данного растворителя (см. Криоскопия). Для коллоидных растворов напр. осмотич. давление и величины депрессии очень малы, что указывает на весьма высокий М. в. их частиц (доходящий до 10 000-100 ООО). 3. М. в. газов и паров, как и плотность их, можно определять по скорости v истечения газа из малого отверстия в тонкой пластинке, так Ki\K скорость эта обратно пропорциональна Vd или VM (Бунзен): м, vi На этом принципеоснован аппарат Шиллинга для определения плотности светильного газа. Таким же образом меняется с М. в. и скорость диффузии газов, на чем основан метод разделения изотопов в газообразном состоянии [напр. хлора-Гаркинс (Harkins)]. Интересным новым кинетич. методом определения М. в. коллоидно растворенных ве-niecTB является метод ультрацентрифугирования, введенный Сведбергом и его учениками (1924). Центрифугируемая со-значительной скоростью плоскопараллельная кювета кинематографируется при прохождении через определенное положение на окружности вращения. Полученный фильм, дающий ряд последовательных состояний седиментирующего под действием центробежной силы коллоидного раствора через одинаковые промежутки времени, микрофотоме-трируется, что дает концентрацию коллоидных частиц на любой высоте сосудика. Определяя отношение этих концентраций Ci, С^ для любых двух высот fti, получаемое после долгого центрифугирования в результате достижения седиментапионного равновесия, т. е. равновесия между центробежной силой и диффузионными силами, находим М. в. по формуле: где со - угловая скорость вращения, а Di и Da - соответственно плотности коллоидных частиц и растворителя. Аналогично можно определять М. в. также и по диффузионным измерениям. Основным микрометодом - элементарным методом определения М. в., позволяющим измерять массы отдельных заряженных частиц (атомов и их групп), является метод Дж. Дж. Томсона, усовершенствованный Астоном в форме массового спектрографа, дающего возмолность с большой точностью определять (отношение заряда к массе), а следовательно и массу т положительно заряженных частиц, образующих каналовые (анодные) лучи; см. Изотопы. Этим методом были определены ат. в. отде.пьных изотопов. Для водорода т. о. были измерены массы молекул Hg = 2,012-2,018 и Нз-3,025-Ь3,027 (считая С = 6). Лит.: Менделеев Д. И., Основы химии,. 9 изд., т. 1-2, М.-Л., 1927-28; Смит А., Введение в неорганич. химию, пер. с 3 нем. изд., под ред. с доб. А. В. Раковского, вып. 1-2, М.-Л., 1929; Вознесенский С. А. и Ребиндер П.А., Руководство к лабор. работам по физич. химии, М.-Л., 1928; Ребиндер П. А., Об ультрацентрифуге Сведберга, УФН , 1926, т. 6, вып. 4-5, стр. 397; Бирон Е. В., Учение о газах и жидкостях, М.-П., 1923; А с т о н В. Ф., Изотопы, пер. с англ. М.-П., 1923; Handb. d. Arbeitsmelhodcn in d. anor-gan. Chemie, hrsg. V. A. Stiihler, В. 3, Halfte 1, В .-Lpz., 1913; Houben J.-W e у 1 Т., Die Metbbden d. ог£гап. Chcmie, 3 Aufl., B. 1, Lpz., 1925; Arndt K.. Handb. d. phys.-chem. Technik, 2 Aufl., Stg., 1923.  Svedberg Т., Kolloid-Ztschr. , Dresden, 1930, В. 51; Alexander J., Colloid Chemistry, v. 1- Theory a. Methods, N. Y., 1926; M orl ey, Ztschr. fur phys. Chem. , Lpz., 1896, B. 20, p. 1, 68, 242, 417; G u у e Ph. A., Journ. de Chimie phys. , Prris, 1907, t. 5, p. 203, 1908, t. 6, p. 769, 1910, t. 8, p. 222; Berthelot D., CR , 1907, t. 144, p. 76, 194, 269, 145, 317; B e с к m a n n, Ztschr. fiir phys. Chemie*, Leipzig, 1888, B. 2, p. 638, 715, 1901, B. 51, p. 337, B. 53, p. 130; в 1 a с к m a n n Ph., ibid., 1908, B. 63, p. 48, 381, 635, 1909, B. 65. p. 549; Thomson J. J., Rays of Positive Electricity a. Their Application to Chemical Analysis, 2 ed., L., 1921; Aston. Na-ture , L.-N. Y., V. 104, p. 334-393. П. Ребиидер. МОЛЕСКИН, чортова кожа, хл.-бум. ткань, напоминающая по внешнему виду демикотон. По своему строению М. принадлежит к видоизмененному сатиновому переплетению (фиг.) и относится к группе уточно-настилочных (сукновидньлс) тканей. Из всех одежных товаров М. является самым распространенным хл.-бум. изделием. М. имеет важное эконолгач. значение как недорогая, прочная и теплая ткань из группы хл.-бум. изделий, благодаря чему фабри-катшя его из года в год усиливается. М. выпускается на рынок или начесанным или только отделанным (окра-шеппым). Начесывание (т. н. в о р с о в а н и е) м. производят или с одной лицевой поверхности или же с обеих сторон ткани. Чтобы начес был ровный по всей поверхности, его подстригают на специальных машинах. По окончании означенных операций и дальнейших-крашения и аппретирования- м. по.тучает подобие сукпа, вследствие чего ему присваивается название М.-сукно. В отделке М. красится в различные цвета, преимущественно в черный, кубовый и коричневый. М. также отбеливается и идет на кителя. в ряде основных признаков доброкачественности существенную роль играет прочность крашения ткани, к-рая не долясна линять от волы и выгорать на свету. М. выра-батьшается по тонкой основе равньш утком и в зависимости от сорта выпускается различной степени плотности п тонины. М. р о в-ный вырабатывается шириною в 71 см. Основа берется № 24, уток № 20; плотность по основе 64, а по утку 110-140 нитей на 1 дм. М.тонкий вырабатывается шириною в 71 см при №№ пряжи-основы 24 и утка 30, с плотностью 64 нити по основе и 160 нитей по утку в 1 дм. М. угарный выпускается шириною 71-142 см. Основа берется № 24, а уток № 6-№ 8, при плотности по основе 58, а по утку 62-88 нитей на 1 дм. М.-с у к н о вырабатывается шириною в 71 см, при основе № 24 и утке № 12 С плотностью по основе в 58, а утку 104 нити на 1 дм. Работается молескин в 5, 6 и 7 ремизок при проборке 1 нити в галю и 2 нитей в зуб берда. с. Молчанов. м. в полиграфии, плотная ткань д.пя октейки переплетов, требующих особой прочности в употреблении,-напр. переплетов конторских и разносных книг. См. Переплетное рроизводство и Ткани технические. МОЛИБДЕН, Мо, химич. элемент VI группы периодич. системы, ат. вес 96,0, ат. но- мер 42; аналог Сг и W, образующий вместе с ними подгруппу (триаду). Физические свойства. М.-серебристо-белый металл; уд. вес 10,02-10,32; твердость чистого М. по Мосу-5,5. Сопротивление его на разрыв зависит от микро<г структуры и от характера обработки и меняется в пределах 70-220 кг/мм; с повышением t° обработки крепость М. уменьшается и для t° около 1 000° достигает минимального значения. Относительное удлинение меняется в зависимости от t° обработки; для проволоки, протянутой при t° между О и 100°, оно достигает максимума (10-18%), при более горячей обработке снижается и для i° около 1000° приближается к нулю; отжиг проволоки увеличивает относительное удлинение; физич. структура (размеры зерна) также оказывает на него влияние. Поперечное сясатие несколько увеличивается с возрастанием t° обработки и с укрупнением зерна. Твердость по Бринелю для не-отоясженного М. равна 160-185. Коэф. сжимаемости равняется (0,34-0,47) 10 см/кг; удельн. теплоемкость в пределах 20-930° равна 0,065-f-0,076 cal/г. Средний коэф. лип. расширения М.для t° 25-100°равен 4,9 10 ; для 25-500°-5,5 10 . Удлинение в пределах t° 0-7-400° может быть найдено по формуле: Д i=0,510 t + 0,0124 Вполне чистый МОЛ! бден по наиболее точным определениям имеет Г„д. от 2 620° ±10° до 2 840° ±40°; на практике обычно прини.мают значение t\j 2 570°; t\yn М. равна 3 650- 3 700°. Теплота горения (Мо -> МоОз) на г-атом М. равна 166-М81,5 Cal. Электрическое сопротивление М. для неотожженной проволоки (при 25°) равно 5,6 10 Q-cm, для отожженной-4,8-10 й-сж; его Г-ный коэф, а (при 20-100°) = 4,73 10. Сопротивление в пределах 0-2 200° выражается форм\лой: е = (44 + 0,177 + 0,000053(2) Ю 2-см; соответственные величины Q приведены ниже в таблице. Удельное сопротивление М. при различных t° в а-сл1.
Сопротивление 1 п. м проволоки из М. при 20° равно 0,0478 Q-мм. Удельн. электропроводность при 0°=22,7 10 МО. Термо-эдс для спая Мо-Р при О-100° достигает 1,26 mV; для спая Mo-W при Д(° = = 540°-12,5 mV; Молибден парамагнитен; его уд. магнитная восприимчивость х при 18°= + 0,04 10- . Химические свойства. На воздухе Мо окисляется медленно уже при обыкновенной t°; с повышением t° щ)Оцесс ускоряется, и при 600° Мо сгорает быстро в трехокись М0О3. Конц. к-ты, а также плавиковая к-та и растворы щелочей на Мо не действуют; при 200-250° конц. HgSO* быстро растворяет Мо, выделяя SO2 и переводя Мо в низший окисел. Царская водка растворяет Мо при обыкновенной t°. С галоидами Мо реагирует-с F уже нри обыкновенной t°, с С1-при t° красного каления, с Вг-при t° белого каления. Переработка руд. В технике для получения металлического М. пользуются главн. обр. молибденитом, MoSg (см. Молибденовые руды). Все методы обработки имеют конечной целью получить из руд трехокись молибдена, М0О3. Для этой цели м. б. применены следующие операции: 1) обжиг руды, 2) электролиз, 3) хлорирование и 4) разложение щелочами мокрым или сухим путем. На практике применяется почти исключительно обжиг. Для этой операции берется концентрат, измельченный и просеянный через сито с 200 отверстиями на 1 ног. дм. К концентрату добавляют кварцевый песок, так как руда по мере окисления уплотняется в комки, что препятствует ее полному окислению; по той же цричине не следует производить очень мелкий размол концентрата. Смесь рудного номола с песком нагревают до 600° при обильном доступе воздуха. Окисление сопровождается саморазогреванием; чрезмерный перегрев ведет к частичному улетучиванию М0О3 и к спеканию руды (в особенности-содержащей Си и Fe). Конец обжига определяют растворением пробы в щелочи: по количеству оставшихся блесток MoSg судят о полноте окисления. Конструкция печей, применяемых при обжиге M0S2, должна удовлетворять след. требованиям. Печь должна иметь такую систему обогрева, чтобы возможно было легко регулировать t° и даже быстро прекращать топку. Воздух должен поступать в окислительное пространство так, чтобы по пути он не смешивался с топочными газами и чтобы приток его можно было регулировать или совсем прекратить. Регулировка нагревания и подачи воздуха должны быть устроены отдельно друг от друга, т. к. при наступившем окислении дальнейшего нагрева не требуется. Печь строится муфельного тина (квадратного или полуцилиндрического сечения)с плоским подом для засыпки руды. В печах большой производительности устраивают ме?:анич. приспособление для удаления обожженной руды. Отходящие газы должны проходить через промывное устройство или через конденсационную камеру для улавливания испарившегося М0О3. При процессе обжига выделяются SO2 и SO3, а также мышьяк в виде AS2O3. Летучесть MoOg при высоких t° послужила основанием к получению МоОз из руды методом возгонки. Для этого руду измельчают в крупку, проходящую через сито с 8 отверстиями на йог. дм. и нагревают при t° выше 790° в атмосфере, содержащей избыток кислорода; образовавшаяся М0О3 улетучивается, конденсируется в виде ныли и улавливается в мешки из плотной ткани. Для предупреждения спекания руды к ней примешивают кварцевый песок или жженую известь. Получаемая MoOg содержит примесь As и Bi. Электролитическая обработка M0S2. Превращение M0S2 в MoOg путем окисления на аноде предлагалось неоднократно, но пока не полу- чило промышленного применения; оно может проводиться либо в кислом либо в щелочном растворе. При кислом процессе и.змельченную руду замешивают с разбавленной серной н-той в тесто и на пластинчатом аноде, расположенном горизонтально, подвергают действию тока в электролите из разбавленной серной к-ты: катод из кислотоупорного металла располагают сверху; электролиз ведется при напряжении 5-7 V, плотности тока 0,2 А/дм.г и Г электролита 90°; при этомМоЗг окисляется в нерастворимую М0О3, а Fe и А1 переходят в раствор; вместе с МоОа осаждается и SiOa; поэтому для очистки М0О3 ее растворяют в аммиаке. При щелочном процессе руду замешивают в тесто со щелочью и укладывают на плоский анод, изготовленный из никеля, или из сплава никеля с 12% М.; электролитом служит 25%-ный раствор NaOH; в этом случае образующаяся МоОз растворяется в э.лектролите, что же касается Fen SiOa, то они остаются в анодном шламе. Разложение M0S2 хлорированием. При этом способе M0S2 прокаливается в токе воздуха, смешанного с газообразным ПС1; в результате получается хлоргидрат МоО(ОН).2С1.2, к-рый сублимируется. Реакция эта м. б. проведена в закрытой подовой печи; указанным методом можно обрабатывать бедные молибденовые руды при условии, что пустая порода руды не образует летучих окислов или хлоридов нри (° реакции. Имеются также патенты на способ хлорирования руд током чистого хлора при f ок. 800°; в первой фазе процесса Мо превращается в хлорид или в хлорокись, к-рые затем расщепляются водяным паром на МоОз и HG1. Обработка M0S2 щелочами м. б. применена как к сырой руде, так и к предварительно обожженной. В первом случае размолотый концентрат смешивают с углекислыми или едкими щелочами, нагревают в печи с перемешиванием выше смеси и продувают через плав смесь воздуха и водяного пара. В результате получается плав, содержащий мо-либдат щелочного металла; его измельчают и выщелачивают водой. Этот метод технически мало пригоден. Более удобным является следующий путь: MoSj хорошо обжигают и, смешав с кальцинированной содой, нагревают в печи нри t° тёмнокрасного каления; образуется полужидкий плав, содержащий щелочной молибдат или димолибдат; его сливают в железные ящики, охлаждают, размалывают и обрабатывают горячей щелочью в железных сосудах. По Perrnet, необожженную руду смешивают с содой, небольшими порциями вносят в печь и плавят; когда печь наполнится, плав окисляют прибавкой нитрита натрия в смеси с известью, вводимой для связывания ЗЮг-Плав тонкой струей выливают в слабый раствор щелочи. Другие авторы предлагают сплавлять обожженный M0S2 с содой и NaCl (или NaF, CaCU, CaFj), прибавляя к смеси окисляющие средства BBHfleNaNOa или NaClOs- Кроме указанных методов сплавления со щелочами существует метод щелочной обработки руды мокрым путем; он применяется тогда, когда молибденовый блеск содержит мало железа, и особенно при использовании бедных руд. Для этого обожженную руду обрабатывают при нагревании крепким раствором кальцинированной соды или замешивают ее в пасту с раствором едкой щелочи и нагревают: образуются щелочные молибдаты, растворимые в воде, в настоящее время получаемые из руды щелочные молибдаты нередко переводят в молибдат кальция (осаждая его из раствора кальциевыми солями или известью при нагревании), т. к. эта соль непосредственно применяется при выплавке молибденовой стали. Полученный молибдат кальция (см. Молибдена соединения) для применения в металлургии освобождают от воды и углекислоты прокаливанием. Германские з-ды запатентовали следующий метод: руду с основными присадка.ми обжигают в печи при окислении воздухом, затем нагревают с добавкой соды и кре.мнезема до спекания и после того сплавляют с сернистой щелочью; обрабатывая плав водой, получают в растворе молибдат натрия. Можно также непосредственно прокаливать в печи смесь руды с сернистой щелочью. Обработку руд, содержащих медь, по Мансфельду, следует производить с прибавкой железа, т. е. связывать Мо в виде молибдата Fe. Кроме молибденового блеска в переработку на М. иногда поступает вульфенит (РЬМо04); попутно из него получают свинец и нек-рые благородные металлы; обработка этой руды ведется обычно щелочным способом (выщелачивание раствором КагЗ при нагревании). Получение металлического М. Чистый М. по.чучают обычно из трехокиси М0О3, приготовляемой прокаливанием молибденовых солей. МоОз восстанавливают водородом; процесс аналогичен применяемому при изготовлении вольфрамовой проволоки (см.); при этом получается наиболее чистый металл (99,95% Мо); этот способ применяется наиболее часто в США. Существует также метод получения чистого М. восстановлением МоОз металлич. кальцием; для этого смешивают тонкие опилки кальция (в двойном количестве против теоретического) с MoOj, помещают в железную трубку, с одного конца заваренную, с другого закрытую крышкой с краном, и для начала реакции подогревают; по окончании восстановления спекшуюся массу извлекают из трубки, измельчают, избыток кальция удаляют водой, а оставшийся М. промывают уксусной к-той; окончательно его очищают промывкой ацетоном и нагреванием в вакууме. М. получают также алюмино-термической переработкой М0О3, которая дает продукт, свободный от углерода, но с примесью небольшого количества SiOg и от 1 до 2% железа. Применение. Металлич. М. получил применение главным образом в производстве специальных видов стали (на что расходуется более 90% всего добываемого М.). Война 1914-18 гг. особенно выдвинула требование на специальные металлы, необходимые для изготовления брони, бронебойных снарядов, оружия, автомобильных и аэроплан-ных частей, постоянных магнитов и частей котлов высокого давления. Инструментальная сталь, приготовленная с добавлением М., менее хрупка, чем вольфрамовая сталь, и лучше выдерживает холодную обработку. Обычно М. добавляют к стали в виде железной или марганцевой лигатуры (с 50- 75% Мо) или в виде молибдата кальция. Мостовые фермы из молибденовой стали с годами становятся тверже, так что с трудом берутся сверлом. Молибден, сплавленный с вольфрамом, дает сплав, который может служить заменителем платины. Новый кислотоупорный сплав состоит из 35% Fe, 65% Сг и 5% Мо. Сплав М. с хромом и кобальтом, т. н. стеллит, применяется для изготовления инструментов высокой твердости. Тройной сплав состава: 304-35% Сг + 60-i-65% Ni 4- 24-5% Мо с небольшой прибавкой Ag нерастворим даже в царской водке и может служить для изготовления химич. аппаратуры (о сплавах М. подробнее см. Спр. ТЭ, т. II). В электротехнике М. применяется в аппаратах, имеющих накаленный катод,-гл. обр. в электронных лампах; раньше он служил также материалом для нитей калильных ламп. При изготовлении пирометров для высоких t° применяется сплав из 75% W + 25% Мо, имеющий Г„д. выше 3 000°; этот сплав в термопаре с W пригоден для измерения темп-р до 2 700° (см. Магнитные материалы). Производство изделий из чистого М. выполняется по методам, применяемым при производстве вольфрамовой проволоки (см.) и отличается только Г-ным режимом. Кроме того в электротехнике, зубоврачебном и ювелирном деле в последнее время стали заменять дорого стоющую платину металлическим, М. Наконец М. входит в состав некоторых катализаторов, применяемых в техническом синтезе аммиака из элементов. Лит.: Критский В. В., Вольфрам и молибден в электроламповой промышленности, МО , 1927, 2; В о г d о J. А., Molybdan, MetaUwirtschart , Berlin, 1928, В. 7, 3; Е а г 1 d 1 е y-W 1 1 m о t V. L., Molybdenum Metallurgy, Uses and the Occurence, Mining a. Concentration of Its Ores, Canada, Ottawa, 1925; Pokorny E., Molybdan, Monographien iiber chem.-techn. Fabrikationsmethoden, hrsg. v. Wohlgemuth, Halle a/S, 1927, B. 40; К i s s о с к A., Molybdenum, Mineral Industry during 1926, New York, 1927; Molybdenum an American Metal for Alloy-Steel, Engineering a. Mining Journal, New York, 1928, v. 125, ; P h 1 1 1 i p s 0 n B. F., Molybdenum, ibid. 1928, V. 125. T. Аленсеенко-Сербин. МОЛИБДЕНА СОЕДИНЕНИЯ отличаются чрезвычайным разнообразием; в основе этого лежит способность Мо в широких пределах менять свою валентность (от 2 до 6), образовывать тяжелые молекулы с большим числом атомов Мо и наконец резко выраженная склонность Мо к комплексообразованию. Известны соединения двух- (?), трех-, четырех-, пяти- и шестивалентного Мо; из них наиболее важньши являются производные Moi - кислотный окисел МоОз, молибденовые кислоты и соли этих кислот. Молекулярная структура М. с. определена с достоверностью лишь для некоторых наиболее простых по составу представителей. Окислы Мо и их гидраты. Окислы Мо образуют следующий ряд: МоО(?), MOgOg, М0О2, Мо205(?), MoOg. Они довольно легко переходят друг в друга при реакциях окисления и восстановления; крометого они способны к сочетанию между собою,с образованием более сложных окислов. Двуокись молибдена, MoOj - бурый порошок или красно-фиолетовые металлически-блестящие кристаллы моноклинной системы, нерастворимые в воде. Уд. в. 4,5-6,4. Вещество неплавко и нелетуче при высоких t°; щелочи и к-ты (за исключением HNO3) не действуют на него даже при нагревании. При накаливании на воздухе или кипячении с азотной кислотой М0О2 окисляется в М0О3. Для получения М0О2 исходят из трехокиси М0О3 (см. ниже), которую восстанавливают в токе чистого водорода при t° не выше 500°, либо же из молибдата аммония - многочасовым сплавлением его с поташом и борной к-той, после чего растворимые вещества удаляют вываркой плава в воде. MoOg применяется для получения металлического молибдена (электролитич. или алюминотермич. путем, либо восстановлением цинком или кальцием); вследствие нелетучести МоОаЭти высох^о-температурные процессы протекают (в противоположность MoOg) без потерь Мо. Предлагалось также применять MoOg для изготовления калильных нитей электроламп и как катализатор в органич. синтезах. Трехокись молибдена, молибденовый ангидрид, МоОз, часто называемый также молибденовой кислотой,-наиболее устойчивое и технически важное из М. с. Безводный М0О3-белый или желтоватый порошок, жирный наощупь; уд. вес 4,4; 795°; из расплавленного состояния кристаллизуется в ромбич. иглах, уд. вес 4,7; при сильном накаливании возгоняется. Растворимость МоОз 2 воде незначительна: при 15°-0,2 ч., при 80°-0,5 ч. в 100 ч. Н2О; растворы имеют кислую реакцию, вследствие перехода М0О3 в соответствующие гидраты со свойствами к-т. МоОз растворяется в едких ще- 1 ... 19 20 21 22 23 24 25 ... 49 |
|
© 2007 SALROS.RU
ПромСтройМат |