 |
 |
 |
 |
1 ... 4 5 6 7 8 9 10 ... 48 Сила нажатия: где S иИа +q) sine sin Q sin (a + e) sin a + fi cos a Для сравнения приводим величины сил Q ичо' при 2а=30°; цилиндрич. колеса: ,fx=0,i; Q = 10.U; клиновидные колеса: (а'=  Фиг. 3. Фиг. 4. = 0,28:Q=3,6.C/. Приведенные цифры указывают на значительное уменьшение силы нажатия Q в связи с применением клиновидного обода. Кпд такой передачи 4 = 0,88- 0,90; на фиг. 3 показана конструкция передачи. 2. Ф р и к ц и о н н а я П. коническими колесам и (фиг. 4). Здесь передаточное число выражается так же, как и в предыдущем случае, т. е.: ние этой П. для перемены направления вращения весьма ограничено. 4. На фиг. 7представлена схемаП. с переменным передаточным числом; цилиндрич. колесо, перемещаемое вдоль вала, работает с конусом, так что при постоянном числе оборотов ведущего вала ведомый получает переменное число оборотов в зависимости от положения ролика на валу 5. На фиг. 8 представлена П. Stevensa. Перемещением ремня достигается изменение передаточного числа. 6. Недостаток П. цилиндрич. колесами, заключающийся в относительно больших усилиях, передаваемых на подшипники, совершенно устранен в передаче Гаррарда (фиг. 9). Устройство передачи состоит в том, что на ведущий шкив а, ведомый b и вспомогательный с надето кольцо d из специальной стали с относительной расточкой. Когда П. не работает, кольцо занимает положение, указанное на фигуре. При вращении ведущего шкива а кольцо  Фиг. 7. а>2 п2 1 Нормальная сила нажатия 1:олес R = J; осевые усилия Qju Q2определяются из силового мн-ка (фиг. 4). = R sin 1 sin <5i; sin (5, 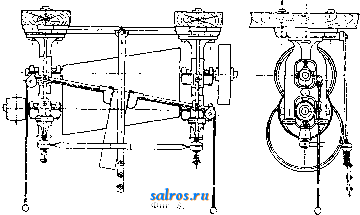 На фиг. 5 представлена фрикционная П. конич. колесами с переменой направления вращения. Поиеременно включая колеса а и b посредством кольца д, получим соответствующие движения колеса В. 3. На фиг. 6 представлена П. м е ж д у взаимноперпендикулярнымива-л а м и, при этом шкив S работает торцовой частью. Передаточное число в этой П.  Фиг. 6. имеет выражение: n:no=x:d/2 (см. фиг. 6), отсюда и=По(ж:й/2), т. е. имеем переменное п с изменением ж; но т. к. с приближением шкива D к оси вертикального вала скольжение быстро возрастает, то примене- занимает положение, показанное пунктиром, повернувшись на некоторый угол относительно точки Е как полюса поворота. Шкивы и кольцо П. работают в закрытой коробке, наполненной маслом. Кпд n.li = 0,98 и больше, чем в ранее рассмотренных П. Передаточное число в этих П, делают от 1 : 2 до 1 : 15. 7. Одной из П., дающей возможность разгрузить валы от ионеречных сил, является передача, представленная на фиг. 10. Устройство передачи состоит в следующем: в диске D, наглухо посаженном на валу 2, закреплены три или четыре оси А, на к-рых вольно сидят колеса 17, приходящие в соприкосновение с кольцом R; это кольцо снаружи обработано на конус. Кольцо О, внутренняя поверхность которого коническая, перемещают ycTaHOBnTcibBbiMH болтами S; в результате такого перемещения кольца О достигается необходимое нажатие между и и. 1 и R VI и. На ось А давление не передается. Передаточное число от вала 1 к валу 2 определяется из следующего рассуждения: колеса 17 катятся без скольжения по кольцу И, а потому центры колес I/ имеют линейную скорость меньшую в два раза, чем скорость точки соирикоспонония кольца и с 1; на основании изложенного имеем: 60 п1 т, 60 Т з d , отсюда г = - = 60 цо где I-диам. окружности, на которой расположены центры колес U. 8. П. с переменным передаточным числом (фиг. 11) состоит из полого конуса, соединенного малым основанием 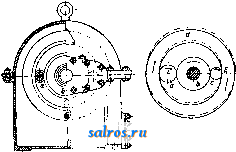 с валом посредством универсальной муфты (см. Рука шарпир)г.абр.. что образующая конуса остается плраллельиой оси вала. Конус приводит во вращение фрикц'юнное пи-липлрич. колесо; от него посредством вала и П1ЯС-тррпи движение передается зубчатому колесу. Конус может быть перемещаем вдоль оси вала, б^сагодаря чему в сопрнкс1Снове41ие 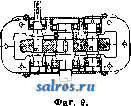 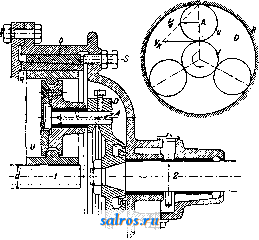 Фиг. 10. с фрикционным колесом приходят различ-нью диаметры его. Э.Комбипацияконусовспрямой и кривой образующими (фиг. 12). Конус А имеет образующей прямую, конус В-кривую. Перемещением пластинок (с е- т. 9. т. XVI. реже к) С и D, связанных шарнирно с подшипниками ва.па конуса В, в соприкосновение нр.шодптся различ.ше частл конусов, в результате чего меняется передаточное число, выражаемое равенствами: а Гл Ml Га 10. фрикционная П. с переменным передаточным числом (фиг. 13). На концах валов насажены фрикционные колеса А и В; и X мIр 1 дио нал ь ные сечения представляют дуги одной окружности. При этом относите.чьиое расположение колес таково, что одна дуга является продолжением дру- фиг. п. гой. Про.межуточное фрикционное колесо С ставится в контакт с каждььм из колос А и />, и в соответствии с его пололеением меняется передаточное число между Л и В. 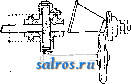 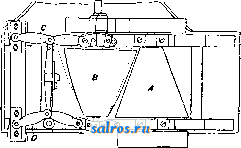 Фиг. 12. 11. Фрикционная П. с конусами и промежуточными роликами для перемены передаточного числа (фиг. 14). П. состоит из конусов Л и В с одной геометрии. ocbFO, при этом один из конусов-в е ду-щий, другой-ведомый. Движение от  Фиг. 13. одного конуса другому передается посредством группы фрикционных роликов С, рас-по.10женных по 01сружности. Эти ролики соединены валами, лежащими в подшипниках, к-рые в свою очередь могут поворачиваться на шипах на требуемый угол в зависимости от положения муфты D. Перемещая муфту D вдоль оси вала, получаем соответствующее полол.ение фрикционных роликов и таким образом изменяем передаточное число. 12. К о м б и н и р о в а н н а я П., состоящая из фрикционной П. и диференциала (фиг. 15). Устройство П. состоит в следующем: две конич. шестерш! F а G вольно (свободно) сидят на оси С; мелоду ними посажены две другие конические шестерни Т и J, сидяпще вольно на оси, нерпендикулярной к оси С и составляющей одно целое с этой последней. Шестерни F и G составляют одно целое 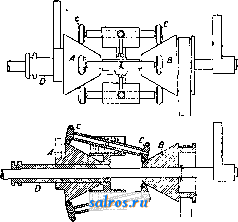 Фиг. 14. с фрикционнъпди дисками D и Е, приходящими в контакт с дисками JV и О, Приведем диск N во вращение посредством ремня в направлении, указанном стрелкой а, и поставим диски В и D на одинаковом расстоянии от центра; тогда диск D придет во вращение по стрелке Ь, а диск Е в направлении обратном; оба диска будут вращаться с одной и той же скоростью. Шестерни F и G, вращаясь с одним и тем же числом оборотов, но в противоположном направлении, приведут во вращение шестерни Т и J, причем их ось останется неподвижной. Если ось С передвинуть по стрелке е, то диски DvlE будут вращаться, как и раньше, в направлениях взаимно противоположных: однако теперь диск D будет вращаться быстрее, чем раньше, а диск Е медленнее. Вследствие этого ось шестерен Т я J вращается вместе с осью С в направлении вращения диска D; скорость вращения оси зависит от разности скоростей шестерен Fи G.Передача дает возможность изменять скорость вращения на весьма незначительную ве.чичину. В зависимости от перемещения дисков в ту или другую сторону вдоль оси можно менять направление ее вращения. Момент, вращающий вал С, зависит от коэф-та трения дисков D я Е, а потому эта П. неприменима для передачи больших мощностей. 13. П. полым конусом и коническим колесом для изменения передаточного числа (фиг. 16). Полый конус В передает вращение конич. колесу С. На фиг. 16 видно приспособление, позволяющее менять относительное положение конуса В и ко- 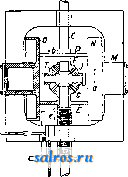 Фиг. 15. леса С и так. обр. изменять передаточное число между шкивами А я Е. Движением рычага F влево перемещается параллельно самой себе опора колеса С. Одним из интересных моментов является тот, когда гео- 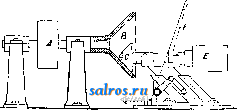 Фиг. 16. метрические'оси конуса и колеса совпадают; тогда оба вала вращаются с одной и той же скоростью, и П. обращается в коническую муфту. Лит.: Худяков П. К. и Сидоров А. И., Детали машин, ч. 1, М., 1907; Б ер лов М. Н.. Детали машин, вып. 4, ч. 1, 4 изд., М., 1929; Р а т н о в-ский Л., Подъемные краны, лебедки, до.мкраты и т. п. подъемные приспособления, т. 2, вып. 4, СПБ, 1915; Бетман Г., Грузоподъемные машины, пер. с нем., М., 1930; L а и d 1 е п К., Die Mascbinenele-mpnte, 4 Aufl., В. 2, Lpz., 1925; ROtscher F., Die Maschinenelemente, B. 2, ВегПп, 1929; Machinerys Encyclopedia, v. 6, N. Y., 1925; К i n d n e г G., Die Ma.4chinenelemente, Stg., 1910. C. Кочергян. ПЕРЕКАТЫ, подводные гребни, косы или перегибы русла (в сторону обмеления), пересекающие фарватер и отделяющие более глубокие его места от перемелей. Вопросы о регулировании мест, где имеются перекаты, являются чрезвычайно серьезными и рассматриваются в связи с вопросом о выправлении рек (см.). ПЕРЕКИСИ, пероксиды, химические соединения, характеризующиеся группировкой -О-О-, состоящей из двух взаимно соединенных атомов кислорода. Выяснению строения перекисных соединений были посвящены многочисленные исследования, т. к. простейшему веществу этого ряда, П. водорода, от к-рого м. б. произведены все существующие перекисные соединения в результате замены одного или обоих атомов водорода, можно приписать следующие формулы: Н . 0-0 . Н; ; ;0 : 0; Н 0 ; О Н I. п. III. Несмотря на тщательное изучение различ-ньгх форм превращения П. водорода и ее производных, вопрос о строении П. до сих нор не разрешен, хотя ф-ла I является химически наиболее обоснованной. Эта ф-ла находит себе ряд подтверждений со стороны изучения физич. свойств (рефракции, спектров поглощения, парахора) и поэтому может считаться если не вполне доказанной, то наиболее вероятной. В зависимости от числа замещенных атомов водорода в П. водорода минеральными или органич. остатками, различают: 1) однозалмещенные производные П. водорода, или гидроперекиси (гидрой е р о к с ид ы), R-0-OH, и 2) двуза-мещенные, или собственно перекиси (пероксиды), RO-OR. Общим свойством всех перекисных соединений является их способность отдавать один из атомов кислорода перекисной труп- пировки в активной форме и тем самым оказывать окислительное действие. Эта способность как правило у гидроперекисей развита сильнее, чем у П., хотя в общем степень окислительного действия в значительной мере зависит от условий среды, 1° и природы окисляющегося вещества. Устойчивость перекис пых соединений также весьма различна и в сильной степени подвержена влиянию разнообразных посторонних веществ (в особенности тяжелых металлов, их окисей и солей), оказывающих каталитич. действие. Многие минеральные П. в чистом виде переносят значительное нагревание, тогда как нек-рые органич. П. и гидроперекиси разлагаются со взрывом при относительно низких t° или при незначительном ударе или растирании. Значение перекисных соединений при изучении явлений окисления весьма велико, т. к. процессы окисления молекулярным кислородом тесным образом связаны с образованием перекисных соединений. Во многих случаях с полной очевидностью было доказано, что образование перекисных соединений является промежуточной стадией окислительного процесса, в других случаях подобный механизм является наиболее вероятным. Практич. значение П. также весьма велико, и многие минеральные П. находят широкое применение в различных промышленных областях. Минеральные перекисные соединения. Все неорганич. П., имеющие практич. значение, за исключением П. водорода (см. Водорода перекись), м. б. отнесены к двум основным группам: 1) перекисным соединениям металлов и 2) ацильным перекисным соединениям или т. н. перкислотам (падкислотам). I. П. металлов. Соединения этой группы П. можно рассматривать как соли Н2О2, которая, являясь двухосновной к-той, может образовывать два типа солей: МеООН и MegOa (где Me-одновалентный металл). Несмотря на то, что соединения, отвечающие по своему составу ф-ле МеОдН, были вьщелены в твердом виде, однако с полной достоверностью установить не удалось, являются ли они действительно солями этого типа или представляют собою молекулярные соединения McjOa и HaOg. Существование этих солей в состоянии раствора однако было доказано измерением электропроводности растворов. Будучи весьма неустойчивыми веществами, соединения этого типа не имеют технич. значения, тогда как соединения типа МеОг играют весьма значительную роль как в технике отбеливания, так и в приготовлении других перекисных соединений. 1) П. щелочных металлов. Из них наиболее важными являются перекиси натрия и калия. П. натрия NajOg получается непосредственным действием кислорода на металлически!! натрий: 2 Na-f-Oa = NaaOg. Технич. интерес к NagOa стал проявляться после того, как был разработан непрерывный способ ее приготовления. По этому способу металлич. Na загрул-сают в алюминиевые сосуды, находящиеся на небольших вагонетках, и подвергают действию воздуха, нагретого до 300°. Вагонетки непрерывно движутся против направления тока воздуха т. о., что дей- ствию газа с наибольшим содерлсанием кислорода подвергаются продукты, содержащие большое количество П., тогда как свежий металлич. Na приходит во взаимодействие с газами, относительно бедными кислородом. Этим устраняются местные перегревы и связанное с ними разложение П. Воздух, идущий на окисление, предварительно освобождают от влаги и углекислоты. На принципе противотока основан другой способ получения Nag О отличающийся более простой аппаратурой. Металлич. Na находится в камерах, соединенных меноду собою последовательно. Воздух поступает т. о., что свежий газ входит в соприкосновение с частично прореагировавшим Na. Противоток осуществляется периодич. переключением направления тока воздуха. На поверхности расплавленного Na образуется корка из П., препятствующая дальнейшему окислению. Поэтому массу перемешивают, а затем вновь подвергают действию кислорода. Для того чтобы по возмонсности уменьшить разъедание алюминиевых сосудов, нагревание массы до нужной t° (300-400°) производят не путем наружного обогревания, а посредством электрич. нагрева сверху (лучистой теплотой). Операцию окисления ведут в плоской железной реторте, разделенной горизонтальной перегородкой на две камеры; нагретый воздух сначала пропускается в верхнюю часть, отсюда он проходит ее вдоль, а затем поступает в нижнюю камеру. NagOj м. б. также получена при нагревании NaO, NaOH или NaNOg в атмосфере кислорода или воздуха. При нагревании смеси, состоящей из NaNOg, NaOH и металлич. Na, также образуется П. NaNOs+S NaOH+2 Na=3 NagOg + NHa. В технике эти способы однако не применяются, и вся поступающая в продажу П. натрия получается непосредственным окислением металлического Na. Продажная NajOg - желтоватый порошок, притягивающий из воздуха влагу и углекислоту. Она содержит 90-92% чистой NajOa, т. е. ок. 19% активного кислорода. В ней всегда находится NaOH и Na-COg, а иногда также небольшие количества глинозема и даже следы ж;елеза, попадающие из аппаратуры. Присутствие железа особенно вредно вследствие сильного каталитич, влияния на реакцию разложения П. Ни при нагревании ни при ударе Na.iOs, не взрывает, но в смеси с Легко окисляющимися веществами образует сильно взрывчатые смеси, иногда взрывающие только от тепла, вьще-ляющегося при поглощении влаги воздуха. С водой NaOj образует ряд гидратов, из которых наиболее интересным является окто-гидрат NaaOg-S HjO, бесцветные кристал.аы с перламутровым блеском. Теплота его растворения составляет 14 000 cal, т. е. приблизительно в два с половиной раза меньше, чем теплота растворения безводной NagOg (34 ООО cal). Это является значительным преимуществом, так как большие тепловые эффекты при растворении вызывают сильный распад П. С твердой или жидкой углекислотой гидрат образует перкарбонаты состава NajCOi-8 HjO или,в случае избытка углекислоты, кислый перкарбонат 4 Na,C04-H2C04. Техтгч. значение П. натрия заклюпается в сраннитрльно высоком содержании активного кислорода, достигающем почти 20%. Поэтому NagOa широко применяют для приготовления персолей, а также для отбелки, для дезин({)екции и как окиглитоль при приготовлении химич. продуктов. Ею пользуются или в виде порошка или в прессованном виде; NflOa можно также плавить и выливать в формы (брикеты). NagOg применяется таюке для регенерирования содержащего СОа воздуха (испорченного) в закрытых помещениях, например в подводных лодках, а таклсе в водолазных аппаратах, пожарных шлемах и т. п. Большую известность получил препарат, состоящий из NajOg и хлорной извести, под названием океилита (см.), применяющийся для получения чистого кислорода. П. калия КдОа, получающаяся так же, как NagOj, технич. значения не имеет. Теоретически интересно выслиее кислородное соединение калия К^О^, получаюи1ееся при окислении металлич. К чистым кислородом, селитрой или при пропускании кислорода над смесью нитрата калия и окиси кальция или окиси магния при /° красного каления. Ка04 получается также при действиикислорода на раствор металлического К в жидком аммиаке при -50°. Эта П. весьма неустойчива, бурно реагирует с водой и при этом распадается на KgOj и Og. Ей приписывают строение КО-О-О-ОК, которое однако мало доказано. П. рубидия, цезия и лития были получены в'сравнительно чистом виде; в технике однако эти П. не применяются. 2) П. щелочноземельных металлов. Приготовление их отличается от приготовления П. щелочных металлов тем, что исходным продуктом является не самый металл, а его окись. Из этой группы наибольший интерес представляет П. бария, долго служившая главныл! источником получения П. водорода. П. бария ВаОа легко получается при нагревании окиси бария в токе кислорода или воздуха при 400-500°. Самой ответственной операцией при промышленном получении перекиси бария является приготовление окиси бария в пористой форме и тем самым наиболее подверженной действию кислорода. Поэтому все способы приготовления ВаОа теснейшим образом связаны со способами переработки прирвдиых и искусственных бариевых соединений на окись бария. Выделение газа из перерабатываемого материала способствует увеличению пористости, тогда как высокая t°, при к-рой наступает плавление или спекание, уменьшает пористость. Поэтому особенно пригодным исходным продуктом является природгшш витерит или карбонат Ва, получающийся в сахарном производстве. Менее пригодны сульфаты Ва, к-рые предварительно восстанавливают в сульфиды. Нитрат бария, получающийся обменным разложением между BaClg и селитрой, слишком дорог и не может служить исходным продуктом для получения BaOg. Было предложено с целью увеличения пористости получаемой ВаО при обжиге вводить различные добавки. Так на- зываемый способ Монда состоит в том, что брикеты из карбоната бария с пеком, углем и окисью магния помещают в вертикальную печь, которую в верхней части нагревают до 1 200°, а снизу впускают воздух, нагретый до 400-500°. ВаО, образующаяся в верхней части печи, опускается вниз, где t° ниже, и превращается в ВаО а, к-рую выбирают. Вместе с тем были сделаны наблюдения, что карбонат бария м. б. количественно превращен в окись тол1>ко при полном отсутствии влаги. Поэтому обжиг рекомендуют вести в закрытых муфелях, обогреваемых снаружи генераторным газо.м. Обжиг продолжается около 12 час; расход угля составляет 125% от веса карбоната. 100 кг карбоната дают 70 кг 95%-1ГОЙ ВаО, которая превращается в 90%-ную BaOg. Иногда к карбонату прибавляют 1-2% железа или его окиси, к-рые каталитически способствуют процессу обжига (так же влияют Ni, Со, Си, Сг и уголь). Операцию окисления окиси бария в П. ведут в чугунных плоских сосудах, находящихся внутри горизонтальных цилиндрич. печей.Продолжительность реакции(/° = 500) зависит от величины загрузки. Большая часть массы после реакции представляет собою куски зеленоватого цвета, которые отбирают, измельчают и в таком виде пускают в продажу. Продажная ВаО а содержит около 90% чистой BaOg. Прежде она применялась для получения кислорода (при высокой t° происходит распад: 2 Ва02= 2 BaO-f-Og); в настоящее время этот способ совершенно оставлен. Главное применение BaOg-приготовление П. водорода (этим способом пользуются только па небольших установках, т. к. существуют более рациональные способы) (см. Водорода перекись). П. кальция и магния CaOg и MgOg имеют нек-рое практич. значение. Они получаются из окисей I или гидрата окиси в случае Са(0Н)8] соответствующих металлов и из П. натрия. Применяются как дезинфицирующие порошки и мази (в медицине, в качестве зубного порошка и т. д.). П. Перкислоты (н а д к и с л о т ы). Соединения этой группы можно рассматривать как П. водорода, в к-рой один или два ато.ма водорода заменены ацилами (т. е. кислотными остатками). Соответственно наличию двух атомов водорода у П. водорода, здесь также возможны соединения типа Ас-ООН (гидроперекиси) и типа Ас-00-Ас (П.); Ас-остаток минеральной к-ты. В случае двухосновных к-т образуются соединения как перекисного, так и гидропе-рекисного типа с функцией сильных к-т, причем носителем кислых свойств является не гидроперекисная группа 0-0-Н, а второй гидроксил двухосновной к-ты, например о SO3H 0-80зН о-п . i SO3H. сульфомонаперкис- персерная к-та лота (к-та Каре) (надсерная к-та) Из перкислот и их солей техническое значение и.меют: а) пербораты, б) перкарбонаты и в) персульфаты. а) Пербораты. Вопрос о строении пер-борной кислоты и ее солей до сих пор еще не выяснен в полной мере. Некоторые исследователи приписывают перборатам строение ПЕРЕКИСИ Me-О-О-ВО, Вместе с тем ряд свойств перборатов заставляет видеть в них не истинные перкислоты, а молекулярные соеди-неЕШя. Из известных солей перборных к-т наиболее важной является перборат натрия, Перборат натрия NaBOa-НгОа-ЗПаО, бесцветное кристаллич. вещество, содержит 10,4% активного кислорода, при обьмсновен-ной 1° растворяется в 10 ч. поды; теплота растворения 11 054 cal, Перборат натрия впервые был получен при взаимодействии молекулярных количеств NaOH, Н3ВО3 и H-fi. Из водного раствора перборат натрия высаживается спиртохМ, в к-ро.м он нерастворим. Дли получения пербората натрия в технике пользуются борной к-той (или BgOg) или бурой. Существуют три группы методов превращения этих веществ в перборат: 1) действием П. водорода в растворе, 2) действием П. натрия и 3) электролитич. путем. В технике при приготовлении обращают тщательное внимание на.отсутствие загрязнений, могущих вызвать р£13ложение, и на поддержание возможно низкой t°. Кроме того стремятся получить перборат в крупнокристаллич, форме, в к-рой он значительно устойчивее, чем в виде порошка или мелких кристаллов. При работе по первому способу сначала приготовляют раствор метабората натрия растворением буры с небольшим избытком едкого натра. После охлаждения к нему прибавляют раствор П. водорода. Реакцию ведут в деревянных чанах. Через некоторое время перборат выделяется в виде больших кристаллов, к-рые отделяют цен-три(1)угированием и быстро высушивают при 40°. Выход составляет 90-94% от теории. Пример: 105 кг буры растворяют в 36,3 кг раствора NaOH (30° Вё) и при охлаждении добавляют 1 100 кг 3%-ного раствора П. водорода; <° поддерживают ниже 10°. Выход 145-150 кг пербората. Процесс протекает по уравнениям: I. N.426407+2 NaOH=4NaB02 + H20; II. NaBOg+H20a+3H20 = NaBOa Н2О2 ЗНгО. При работе по второму способу после реакции остается избыток щелочи, вредно влияющий на стабильность продукта: 2Na202+B203+H20=2NaB08+2NaOH или 4Na202 + Na2B407+3H20=4NaB03+6NaOH, Для удаления этого избытка раствор нейтрализуют НС1 или СО2; последняя имеет то преи.мущество, что можно пользоваться больишм избытком к-ты. Кроме этих способов, базирующихся на растворах, получение пербората можно вести сплавлением. Напр. смесь буры и NajOg с добавление.м воды или без нее нагревают до плавления или же вносят NajOj небольшими порциями в расплавленную буру. Полученная масса содержит перборат. Эти препараты значительно беднее активным кислородом и применяются в качестве моющих и отбеливающих средств в мелких производствах или в домашнем обиходе. Перборат натрия м. б. таюке нрлучен не из перекисных соединений, а непосредственным окислением (вдуванием кислорода под давлением 50 atm) расплавленного едкого натра в присутствии боратов и катализаторов-соедине- ний железа, марганца или ванадия. Способы эле1трохимическо10 получения пербората начали применять лишь недавно. Существуют дна метода третьего способ а-электрохимич. приготовления пербората: 1) перборат образуется на аноде, 2) активный кислород получают на катоде. Механиз.м анодного превра1цения состоит по-видимому в том, что первично образованный перкарбонат (из карбоната, намеренно прибавляемого к раствору) разлагается на карбонат и П. водорода, к-рая затем присоединяется к метаборату. Вещества, повышающие величину анодного напряжения, напр. хроматы, флуорпды, увеличивают выход тока. Электролиз проводится в ваннах высотой ок. 95 см и диам. 55 см с конусным дном при t° 12-15°. Анод-платиновая сетка; расстояние .между электродами 7,2 см. Рецепт ванны: 45 ч. буры, 130 ч. карбоната натрия, 45 ч. бикарбоната, 2 ч. бихромата калия, 2 ч. силиката натрия. Электролиз ведут при 7 V с плотностью тока 3 ООО А/м^. Полезный выход тока составляет около 50%. Основанием для катодного способа послужило наблюдение, что водород, образующийся на катоде, при известных условиях может соединяться с растворенным в электролите кислородом в П. водорода: 2 Н-1-02= HgOa-Этим путем, применяя повышенное давление кислорода (около 50 atm), можно получить 3%-ный раствор HgOg. Если электролиз вести в щелочной среде и при обыкновенном давлении, то HgOg можно получить в количестве, вполне достаточном для технич. использования. Катодом служит ртуть; 1°=10°. 8 течение электролиза на катод пропускают кислород или воздух. Перборат натрия по этому способу получается с выходом в 70%. Из электролитич. способов получения пербората нат1)пя наибольшим распространением пользуется метод анодного окисления (проводится в широких размерах фирмой Scheideanstalt). хотя и этот способ, вследствие больших затрат на платину, менее рентабелен, чем способ с П. натрия. Водные растворы пербората натрия ведут себя как свободная борная кислота, свободная П. водорода и едкий натр. Ще.лочные растворы пербората натрия-сильш.1е окислители; в кислых растворах, наоборот, он действует как восстановитель. Перборат обладает одновременно отбеливающими и мою-пшми свойствами, почему применяется для беления шерсти, шелка, соломы, фетра, рога, жиров, кости, губок, воска и для приготовления различных препаратов, из к-рых наибольшее распространение получил п е р-с и л ь-смесь из мыла, кальцинированной соды, силиката натрия и пербората; о з он и т-те же составные части только в другом соотношении; перборин -: состоит из мыла, пербората и едкого натра. Пербораты калия и аммония практич. значения не имеют. Пербораты кальция и магния обладают большой термостабильностью и потому часто при.меняются при отбелке в кипящей ванне. Содержание активного кислорода в них колеблется от 9 до 12%, в зависимости от способа приготовления. Их приготовляют обменным разложением пербората натрия с растворимыми солями кальция или магния. б) Перкарбонаты. Известны соли надугольных к-т, отвечаюгцих следующим формулам: OONa ONa OONa OONa /ООН к. о -о С0< >С0; ONa NaQ/ ,OONa сое и со( ONa ОН а также кислые соли. Строение их однако не доказано. Вполне вероятно, что они, аналогично многим перборатам, представляют собою молекулярные соединения карбонатов с П. водорода. Первый перкарбонат был вьщелен путем электролиза карбоната калия при Г-15° в виде соли состава К^С^О^. Перкарбонаты получаются согласно следующим реакциям: 1) из твердой NagOa и СО3 получается соль Na2C04: Na202 + СО2 = Na2C04; 2) из NajOa, СОа и воды: I. NaaOa + НаО = NaOOH 4- NaOH, II. NaOOH + NaOH + H2CO3 = NaaCO + 2HaO; 3) ИЗ NaaC04 при избытке CO a получается NaaCgOg; 4) из NaOOH и СОа образуются соли NaHCOi и NaaCOs. Вследствие неустойчивости перкарбонаты в технике не нашли применения. в) П е р су л ь ф аты-соли надсерной кислоты HO-SOa-O-OSOa-OH. Свободная к-та плавится при 60°. Ее водные растворы устойчивы. При высоких 1° или в присутствии серной к-ты распадается на H2SO4 и HgOg; распад протекает через стадию образования сульфомоноперкислоты (к-ты Каре) HaSOg. Надсерная к-та-сильный окислитель: соли окиси хрома переводит в хро-маты, из растворов марганцевых солей выделяет MnOg, но в отличие от П. водорода не обесцвечивает раствор перманганата, не окрашивает титановой к-ты в желтый цвет и не дает реакции на надхромовую к-ту. Обесцвечивает растворы индиго, окисляет спирт в альдегид и переводит анилин в черный анилин. В чистом виде надсерную к-ту приготовляют действием хлорсульфоновой к-ты на П. водорода. Она образуется также при электролизе конц. серной к-ты. Электролиз ведут со свинцовым катодом и платиновым анодом, плотность тока 500 А/дм, при 4 V и t° 5-6°, уд. вес серной к-ты 1,35- 1,5, выход 67%. Охлаждение анода повышает выход. Этим путем можно получить 40%-ный раствор надсерной кислг}ты с выходом (по току) ~50%. Надсерная кислота отделяется от серной через хорошо растворимые в воде бариевые соли. Соли надсерной к-ты, персульфаты, обладают теми же свойствами, как и свободная к-та. Они дают характерные реакции: окрашивают w-фенилендиамин, м-аминофе-нол, 2,4-диаминофенол и а-нафтол в щелочных растворах в темнофиолетовый цвет, а /3-нафтол-в желтый. Соли аммония, калия, натрия кристаллизуются без воды. В безводном состоянии они устойчивы, в присутствии влаги медленно разлагаются с выделением озона. При нагревании персульфаты распадаются: К28208=К2804-Ь80з-1-0. Персульфат калия трудно растворим в воде; остальные, особенно соль натрия, легко растворимы. При растворении персульфатов в воде, подкисленной серной к-той, они распадаются сначала на к-ту Каро, к-рая затем разлагается на H2SO4 и HgOg. Персульфаты обычно получаются электролизом кислых растворов соответствующих сульфатов. Важнейшими соединениями надсерной кислоты являются персульфаты аммония, калия и натрия. Персульфат калия KaSgOg, большие пластинчатые кристаллы или длинные призмы. В 100 8 воды при 0° растворяется 1,76 г соли, при комнатной t°-около 20 г. Водные растворы медленно разлагаются с выделением кислорода и образованием бисульфата калия.Приготовляется из персульфата аммония и сульфата калия или электролизом насыщенного раствора бисульфата калия в качестве анодной жидкости и разбавленной серной к-ты в качестве катодной. Применяется как окислитель. Персульфат аммония (NH4)2S208, бесцветн. моноклинные кристаллы. В 100 ч. воды при 0° растворяется 58 ч. персульфата, при комнатной t°-65 ч.; является наиболее легко получаемым персульфатом. При диа-фрагменном способе электролиза в качестве анодной жидкости берут насыщенный раствор NaaSOj в разбавленной серной кислоте (8 объемов НаО на 1 объем конц. H2SO4). Катодной жидкостью служит раствор серной кислоты (1 объем НдО на 1 объем H2SO4). Катод-свинец, анод-платина, сила тока 2-3 А, напряжение 8 V, Г 10-20°. Плотность тока 20 А/дм. Выход тока при 50 А- 50%, при 150 А-60%, при 300 А-70%. Анодная н{идкость после использования насыщается сульфатом и снова поступает в электролиз. Без диафрагмы электролиз ведут в аммиачном растворе при 7-8° в присутствии небольшого количества хроматов. Персульфат натрия NaaSjOg, легко растворимые в воде кристаллы. Соль получают действием персульфата аммония на конц. раствор едкого натра или растиранием персульфата аммония с содой. Электролитич. путем эта соль получается труднее, чем (NH4)2S208. вследствие большей растворимости. Электролиз обычно ведут без применения диафрагмы в присутствии веществ, повышающих анодный потенциал (напр. плавиковая к-та, НС1, перхлораты). Особенно пригодны для этой цели цианиды, ферроцианиды, ро-даниды и цианаты. Растворимость соли м. б. в значительной степени понижена прибавлением серной к-ты. При электролизе раствора из 150 3Na2SO4-10H2OH70 3KOHn. H2SO4 (в этом растворе растворимость персульфата натрия падает до 6%) и при достаточной плотности тока вредное влияние катодного восстановления в значительной степени уменьшается. Плотность тока 0,2 А/дм для анода и 4 А/дм для катода; f°=17°. Анализ. Надсерная к-та и персульфаты качественно обнаруживаются путем различных окислительных реакций, напр. окислением щелочных растворов солей Мп, Со, Ni, РЬ, образующих черные осадки. Растворы гваякола окрашиваются в синий цвет. Для персульфатов особенно характерной является трудно растворимая соль стрихнина, H2S20g(C,iHj202Na)2-H20 (при 17° 100 сж воды растворяют 0,04 г этой соли). Количественно надсерная к-та определяется в виде H2SO4, к-рая образуется при действии SO а на растворы надсерной к-ты: HaS208 + S02+2H20=3H2S04. Объемным путем персульфаты определяются посредством восстановления раствора FeS04 при 60-80°: HaS208+2FeS04=Fe2(S04)3+H2S04, и обратным титрованием избытка соли закиси железа. Персульфаты применяются в качестве отбеливающих веществ. Они являются сильными деполяризаторами гальванич. элементов. Применяются для удаления фиксажа с фотографич. пластинок, для окисления солей закиси железа в соли окиси, в качестве стабилизаторов медноаммиачных растворов целлюлозы; они находят также разнообразное применение в химич. анализе. Кислота Каро, сульфомонопер-кислота, НО-SOa-О-ОН, плавится при 42°; получается так же, как надсерная к-та, с той только разницей, что хлорсуль-фоновая к-та берется из расчета 2 молей на 1 моль П. водорода. В концентрированных сернокислых растворах разлагается относительно быстро, тогда как в 8%-ной серной к-те кислота Каро б. или м. устойчива; образуется также при гидролизе надсерной к-ты: Н80з.О-0.80зН + Н20 = Н0 80гО OH+H2SO4. Скорость этого превращения зависит от концентрации серной к-ты, являющейся катализатором. При растворении персульфата аммония в конц. серной к-те реакция кончается через несколько мин. Для получения жидкого реактива к-ты Каро 10 г персульфата калия растирают с 11 г конц. H2SO4 и разбавляют 50-кратным объемом воды. Если же к этой смеси вместо воды прибавить 30 г порошкообразного сульфата калия, то получают реактив в твердой форме. К-ту Каро получают также разбавлением 5 %-ного раствора П. водорода 5-кратным количеством охлакденной конц. серной к-ты: H20a+H2S04=HaS05+H20. Калиевая соль к-ты Каро, в отличие от той же соли надсерной к-ты, хорошо растворима в воде. Для к-ты Каро характерна реакция с первичшлми ароматич. аминами, к-рые она превращает сначала в нитрозо-, а затем в нитросоединения. От надсерной к-ты она отличается тем, что моментально реагирует с йодистым калием, от П. водорода-не дает желтого окрашивания с титановой кислотой. Широко применяется в лабораторной технике в качестве окислителя. Органические перекиси и гидроперекиси. К ним относятся органич. производные П. водорода. В зависимости от природы органич. радикала различают алкильные и а ц и л ь н ы е перекисные соединения. Первые п[)оизводят от перекиси водорода, атомы водорода которой заменены а л к и л а-м и,напр.СНз-0- ОН-гидроперекись метила, CjHj-О-ОСгНб-перекись этила; вторые- ацилами (остатками карбоновых кислот), напр. CgHg - СО - О - ОН-гидроперекись бензо- ила, СНзСОО-О-СО-СНз-П. ацетила. Кроме этих двух главных групп существует ряд перекисных соединений, строение к-рых относительно мало изучено. К ним напр. относятся перекисные соединения, образующиеся при автоокислении ненасыщенных веществ, содержащих предполагаемую груп- пировку с-с<, а также П. кетонов и простых эфиров. Алкильные перекисные соединения получаются из соответствуюнщх диалкилсульфатов и П. водорода в присутствии едкой щелочи. В зависимости от количества взятой П. водорода получаются П. или гидроисрекиси. Первые при нормальных условиях представляют собою жидкости (за исключением газообразной перекиси метила CHg-O-O-CHg) с эфирным запахом, взрывающие при нагревании и от удара, количественно распадающиеся в присутствии солей закиси железа на альдегид и алкоголь: СПз.СН2-0-0-СН2.СНз=СНэ-СНО-1-СНз-СН20Н. Вторые-жидкости с едким запахом; обладают свойствами слабых к-т; с едкими щелочами образуют сильно взрывчатые соли, полностью разлагающиеся при действии углекислоты на карбонат и свободную гидроперекись. При реакции меноду бариевыми солями гидроперекисей и хлорангидридами к-т получаются перекисные эфи{)ы этих к-т: (СНз)аСН.О-О. (СНз)гСН О-О^ бариевая соль С1С0 хлорангидрид гипроперекиси терефталеиой изопропила к-ты (СНз)2СН о-осо. (СЫз)2СН0-0.С0/ Алкильные гидроперекиси и П. водорода присоединяются к альдегидам с образованием оксиалкильных П.: 2СН20--Н202=НОСН8 0-0 СН2ОН; п. пиоксиметила СНзСНО-ЮНз-ООН=СНзСНОО ОН, оксиэтилметилпе роксид Алкильные гидроперекиси и оксиалкильные П. представляют значительный теоретич. интерес с точки зрения понимания механизма окисления углеводородов и процессов окисления, протекающих в живой клетке. Ацильные перекисные соединения являются наиболее изученными веществами этой группы; они получаются из хлорангидридов или ангидридов соответствующих к-т и П. водорода в присутствии щелочи или П. натрия. В большинстве случаев-твердые кристаллич. вещества без запаха, трудно раствори.чые в воде, довольно устойчивые при обыкновенной Ь° и разла-гаюшиеся при нагревании. Некоторые из них, напр. П. ацетила CHg-CO-OO-COCHj, взрывают при легком растирании, обнаруживая сильное бризантное действие. Из апиль-ных перекисей особый интерес представляет П. бензоила CgHg- СО- О - О - СО - CgHj, бесцветные кристаллы, 106-108°, бурно разлагающаяся при сильном нагревании; почти нерастворима в воде и слабо-в холодном алкоголе. Получается при взбалтывании П. водорода и хлористого бензоила в присутствии раствора едкого натра, а таюке из П. натра и хлористого бензоила в водном растворе. В технике всегда применяется в мол-кора.здробленном состоянии. Для этой поли ее измельчают в деревянных вращающихся барабанах с фарфоровыми шара.ми, добавляя волу, бензол или т. п. жидкость, или при получении ее отлагают на кварцевой муке, измельченном фосфате кальция или другом субстрате. Например 280 г CgHs С0С1 медленно, при хорошем охлаждении (1° не выше 10°) и перемешивании приливают к жидкости, состоящей из 1 300 г 3%-ного раствора П. водорода и 280 г 33%-ного раствора NaOH, в к-рой находится 800 г кварцевой муки. Выделившуюся на кварце П. отфильтровывают и сушат. П. бензоила под названием л ю п и д о л а применяется для осветления растительных и животных жиров и масел или иод названиелг новаделокса (15 г П. бензоила, 15 г фосфата кальция)- для отбелки муки. Ею пользуются также для обесцвечивания целлулоида и для лечения ран. Прибавление П. бензоила к дрожжам повьппает их активность. Ацильные гидроперекиси (перкислоты) являются промежуточными продуктами при окислении альдегидов кислородом: СвН5-СН0 + 02 = СбНд со ООН; CeHs со OOH + CeHs СНО=2СнН5 СООН; получаются при перегонке смеси из соответствующей карбоновой к-ты или ее ангидрида и 98-100%-ной П. водорода в присутствии небольшого количества конц. HaSO: НС00Н+Н20,=НС0 0-0Н + Н20. другой способ получения состоит в расщеплении П. алкоголятом натрия в алкогольном растворе: CeHs со-о I +NaOC2H5 = СвНб-СО-О =СвН5 со OONa+CeHs CO-OCaHj. Ацильные гидроперекиси - частью жидкости, частью кристаллические вещества, легко растворяющиеся в органич. растворителях. Твердые гидроперекиси весьма мало устойчивы. Еще менее стабильны их соли, которые бурно разлагаются под влиянием тепла, выделяющегося при поглощении влаги воздуха. Обладают сильными окислительными свойствами: мсментально выделяют иод из растворов йодистого калия, обесцвечивают индиго и т. п. Легко отдают ненасыщенным соединениям один атом кислорода, присоединяющийся по месту двойной связи: CeHiCOO-OH + >C :СС = CgHs С00Н + :; С-С <; \ / о окисляют альдегиды в к-ты, переводят первичные амины в нитрозосоединения, азосо-единения-в азоксисоединения. Ацильные гидроперекиси применяются в органич. синтезе в качестве окислителей. Лит.: О i г s е w а I (1 С. Aiiorpanische Peroxyde und Per.saize, Brschw., 1914; FortscJirilte in der anor-ganisdi-chemiscben Industrie, In-sg. v. A Brauer u. J. DAn.s. B. 1-3, Berlin, 19?f -1930 (незакончепо); Van i no L., Das Natriumsuiteroxyd, Wien-Leipzig, l:i03; R i e с tl e A., AlkyIperoxyde und O.sonide, Dresden, 1931; Mel lor J. W.. A Comprehen.ive Treatise on Inorganic a. Tlieoretical Ciiemistrv, v. 5, p. 115, V. 6, p. 82, V. 10, p. 475, L., 1924-1930; Ullm. En/.., B. 2, p. 561, 2 AuH.; Die Methoden der organi.4clien Chemie, hr g. v. J. Houben-Wevl. B. 3, p. 2.in. 2 АчП.. Lpz.. 1923. C. Медведев. ПЕРЕКИСЬ ВОДОРОДА, см. Водорода перекись. ПЕРЕКЛЮЧАТЕЛИ, KOM.4iiw,nmopu (см.), приборы, служащие для изменения соединений в электрич. цепях. Термин П. обыкно- 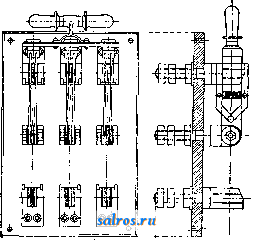 Фиг. 1. венно применяется для приборов, посредством которых осуществляется переключение на небольшое число направлений. При большом числе возможных переключений прибор обыкновенно называют коммутатором. Наибольшее распространение получили П. для установок сильного тока с напряжением до 500 V: они нормально выполняются для переключения на два направления и обыкновенно конструируются по принципу рубильника (см.). Такие П. выполняются с момептным выключение.м Гфиг. 1), когда операция переключения производится под током. В этом случае П. снабжаются кроме основных ножей, рассчитанных на длительное прохождение тока, искрогасительными контактами или же отрывными 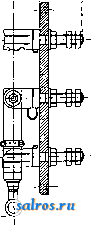 Фиг. 2.  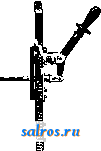 Фиг. 3. ножами.При отключении главного ножа пру-исина натягивает отрывные ножи, которые быстро размыкают цепь. В тех случаях, KOI да переключение совершается не под током, применяется И. без момептного вышпо-чения (фиг. 2), что упрощает конструкцию переключателя. Для защиты обслуживающего персонала от дуг, которые могут образоваться при переключении, а также от прикосновения к токоведущим частям П. или  Ж Фиг. 4. снабжаются защитньгми кожухами или же выполняются со специальным приводом для установки токоведущих частей сзади распределительного щита и с приведем, располагаемым спереди щита (фиг. 3). Операция переключения может осуществляться вручную или автоматически. Автоматич. П. получили весьма широкое применение в салшх различных областях электротехники. Для при-.мера приводится схема (фиг. 4, А и 4, Б) и конструкция (фиг. 5) автоматич. П. для де- 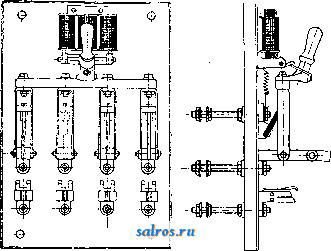 журного освещения для переключения при отсутствии напряжения в сети на независимый источник тока, напр. аккумуляторную батарею. П. в установках высокого напряжения обыкновенно выполняются как комбинация из ряда других аппаратов: разъединителей (см.) и масляных выключателей (см.), причем если операция переключения должна производиться под током, то переключающие контакты помещаются в масле. Лит.: Ш о р е Р., Электрическая аппаратура, пер. с французского, М.-Л., 1929; С о а t е s VV. А., The Ciioice of Switchsear for Main a. Substations, London, 192.i: N i e t li a m m e г F.. Berechnung u. Entwurf elektriseller Masctiinen, Apparate und Anlagen, B. 3, Elektrische Schaltanlagen u. Apparate, Stg., 1905 В I u m e I-.. F., Load Ration Control, General Electr Review , v. 31, Schenectady. 1928, 5, 4; P a 1 m e A. Transformers with Load Ration Control, .IATER 1930, v. 49. П. Корнеев П. вагонных весов. С появлением на же лезиых дорогах вагонов Кушмапа, Арбе-ля и позднее а.мериканских большегрузных вагонов взвешивание их в два приема на обыкновенных нормальных вагонных весах затрудняло пользование ими и вызывало неправильные показания веса вагонов с грузами. Взвешивали одну тележку вагона, пото.м другую, записывали результаты и наконец записи суммировались. Т, о, приходилось для каждого отдельногю вагона делать до трех записей. Кроме вызываемой этим потери времени и увеличения вероятности ошибок при записи результатов и их суммировании самое взвешивание являлось неправильным: 1) при взвешивании одной тележки другая находится на неподв1гжных рельсах пути, пмеет место связь платформы с нек-рой точкой вне весов, противодействующая надлежащему колебанию весов и вызывающая грубые неправильности в показаниях весов; 2) т. к, рельсы путей, равно как и рельсы на платформе весов, не всегда строго горизонтальны, то отсюда вытекает вторая возможность неточности показаний весов, В целях устранения этих недостатков перешли к строительству вагонных весов с длинными платформами. Наряду с весами с платформой длиною 6.4;№ (2Г) появились вагонные весы с плат(1)ормой длиною 12,8 м для взвешивания вагонов Кушмана и Ар-беля и длиною 17 м для спаренных общим грузом вагонов-платформ. На некоторых станциях ж, д имевших небольшой грузооборот, приходилось устанавливать вторые весы, строить вторую весовую будку, группировать однотипные вагоны вместе и так, обр. увеличивать маневры подвижного состава на станции. В заключение пришли к мысли об устройстве такого весопого агрегата, на котором .можно было бы взвешивать как короткие, так и длинные вагоны, входящие в состав одного поезда без расцепки. Эта задача получила свое разрешение с введением двойных (сдвоенных) вагонных весов, состоящих из 2 плат(юр.м длиною 6,4 п 0,68 м или по 7,3 м каждая (общая длина 14,0 м), затем появились весы с 2 нерапными весовыми платформа.ми 6.68 и 10,33 м,или всего-примерно 17 и т. д. Двойные весы длиною \1 м дали возможность взвеишвать все типы вагонов. Когда на ж, д, возникло стремление взве1иивать составы поездов из различных типов вагонов без расцепки на ходу, то-оказалась еще более целесообразной экс-плоатация тройных весов, т. е. с 3 платформами, установленными рядом впритык, общей длиною около 18 м. При двойных весах (фиг. 1), иапр, общей длиною до 17 jm, и размерах платформы: левой-6,68 м и правой- 10,33 м, нормальной длины вагоны взвешивают на левой меньшей платформе, причем Фиг. 5. 1 ... 4 5 6 7 8 9 10 ... 48 |
|
© 2007 SALROS.RU
ПромСтройМат |