 |
 |
 |
 |
1 ... 8 9 10 11 12 13 14 ... 48 кромках (мешки, пожарные рукава, круглые фитили). Ыа фиг. 31 представлена полая мешковая ткань и ее гроденаплевый рисунок переплетения. Для выработки мешко-вой ткани требуется одна, усиленная по  Фнг. 32. числу нитей, основа и один общий уток. Отношение одного слоя основы к другому 1:1. Ыа фиг. 32 приведено переплетение двойной ткани, в построении к-рой участвуют две самостоятельные основы и два утка, которые образуют гроденаплевое переплете-  Фиг. 33. ние с одной и другой стороны ткани. К этому виду переплетения близко подходят переплетения тканей так называемого пи-кэ (фиг. 33). 3) В о р с о в ы е П. т. обладают особенностью производить на ткани образование ворсовой поверхности, причем при своем первоначальном образовании этот ворс имеет вид петель, образованных либо основой  Фиг. 34. .чибо утком, которые затем расчесываются особыми приспособлениями. Смотря по роду нитей, образующих ворс, ворсовые ткани делятся на основноворсовые ткани (напр. бархат) и на уточноворсовые (плис, Манчестер). Основноворсовые ткани требуют двух основ: грунтовой, или изнаночной, и ворсовой. Уточноворсовые ткани состоят из од- ной основы и двух утков, из которых одни именуется грунтовым; он переплетается с грунтовой основой, а другой-ворсовым, образующим ворсовую поверхность ткани. Отношение ворсовой основы к грунтовой 1:2. Ворсовая ткань с низким ворсом называется бархатом, а с высоким ворсом-плюшем. Фиг. 34 представляет разрез уточного, фиг. 3.5-основного бархата. Для получения бархата в 2 полотна-саморезного-  Фиг. 35. требуются три основы:, две грунтовых и одна ворсовая основа, усиленная числом нитей. Разрез двухполотного бархата представлен на фиг. 36. 4) Ажурные П. т. являются сложной группой переплетений, требующих особого 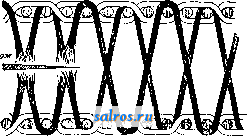 Фиг. 36. приспособления для получения на тканхФ свойственного этому переплетению эффекта. Характерной особенностью тканей этого рода переплетения является изменение в процессе тканья направления отдельных основных нитей, к-рые из прямолинейного положения интервалами принимают извилистое направление. Такое перемещение между собой основных нитей образует в ткани просветы и соответствующий рисунок переплетения. Для изготов-ленияткани с простым ажурным переплетением требуются две основы: коренная (стоевая) или ажурная, пе-ревивочная. Уток один. Перемещение нитей достигается особой ремизкой, называемой крылом с подкрылком. При усложнении рисунка П. т. вводится ряд новых основ как перевивочных и строевых, так и дли получения дополнительного эффекта в виде мелкоузорчатого или иного рисунка переплетения. Фиг. 37 представляет ажурную ткань, а на фиг. 3R показан рисунок переплетения этой ткани.  Фиг. з:  Фиг. 3 8. Класс фасонных, или не а к к а р-довых, П. т. объединяет все те виды переплетений, величина основного раппорта которых превышает возмолшую норму, установленную для раппорта при работе на каретках Добби. Т. о. переплетения, основной раппорт которых будет содержать более 30-40 нитей (фиг. 39), могут быть выполняемы только лишь при помощи машины Жаккарда, к-рая системою арката, вместо подъема основы ремизом, производит индивидуальный подъем основных нитей, соединенных в группы однородных по рисунку нитей. Такой способ дает возможность увеличивать размер раппорта например до 400, 1 ООО и 2 400 нитей, а вместе с этим-укрупнять, усложнять и разнообразить, рисунок узора П. т. Ткани, вырабатываемые при помощи машины Жаккарда, называются фасонными, или жаккардовыми. Этот класс переплетений изобилует чрезвычайным разнообразием, которое представляет собой сочетание переплетений различных к.лассов и их отдельных подгрупп, построение главнейших из  Фпг. 39. которых было изложено выше. Фасонный класс возможно подразделить на следующие три группы переплетений: 1) некруп-ноузорчатые, 2) крупноузорчатые и 3) сложноузорчатые, построение которых производится индивидуально в каждом отдельном случае (см. Патронирование). Класс фасонных переплетений является наивысшей сту- пенью и достижением техники переплетений и ткацкого производства, с помощью к-рых представляется возможпость выполнять ткани, начиная с простого узора (фиг. 39) и кончая художественными произведениями в виде портретов, тканых картин на различные сюжеты, тканых обоев и др., см. Патронировагше. Лит.: Г а и е ш и U с. А., Технология волокнистых веществ, П., 1915; Л а п н с о в А. Г., Руководство по анализу и заправке тканей, Варшава, 1903; И л е й и К. Д., Ткачество в суконном производстве, ИваноБо-Вознесенсн, 1927; Ш о р п н А. И., Опыт практич. руководства к механич. ткачеству хлопчатобуманшых тканей, Книги 1, 2, М., 1881; Б а к у и Н. К., Теория ткацких пореплетени11, Ы., 1930-31; X вальков-с к и й в. II., Теория переплетений и анализ TKaneii, М., 1930; N 1 S b е t Ы., Grammar of Textile Desjni. 2 ed., L., 1919; В a r к e r A. F., An Introduction to the Study of Textile Design, 2 ed., L., 1924; Watson W., Textile Design a. Colour, L., 1922; W a t-s 0 n W., Advanced Textile Design, L., 1913; К a s t an e к J., Leitfaden fiir den Unterricht in der Bindungslehre, Briinn, 1901; Bittner E., Katechisrnus der Bindungslehre, Briimi, 1909; G r u n e г A., Theorie d. Schaft- u. Jacquard-Gewerbe, W., 1902; Donat F.. Melliodik d. Bindungslehre, Dekomposition u. Kelku-lation fiir Schaftweberei, 3 Aufl., W.-Lpz., 1908; D о n a t F., Die farbige Gewebemusterung, W., 1907: В 0 s h e с к W., Die Florgewebe, W., 1905; F i n-sterbusch R., Die mechanische Weberei u. dit-Fabrikation d. Kunst- u. Figurendreher, Altona, 1889; L a m о 1 tier P., Eludes des armuree-satins, *Indu-strie Textile*, P i901. C. Молчанов. ПЕРЕПЛЕТНОЕ ДЕЛО, см. Типографское дело. ПЕРЕРАБОТКА ПЛОДОВ И ОВОЩЕЙ, см. Консервное дело, Сушка плодов и овощей, Соки. ПЕРЕЦ, группа растений южных стран, плоды (а иногда и листья) которых употребляют как пряность. Черный и белый П. представляют высу1пенные плоды от тро-ппч. растения Piper nigrum (сем. Piperaceae), причем черный П.-незрелые плоды, а белый-зрелые плоды, освобожденные от внешней плодовой обо.лочки. Своим острым вкусом П. обязан эфирному маслу и п и п е р н-н у CiHigNOg-слабому органич. основанию, распадающемуся при кипячении с КОН на пипериновую к-т у и пиперидин. Содержание эфирного масла: в черном П. 0,6-1,9%, в белом П. 0,5-1,4%; содержание пиперина: в черном П. 4,6-13,0%. в белом П. 4,6-9,1%. Общее количество добываемого П.-26 ООО т в год, из них 14 ООО m дает о. Суматра. Лучший сорт П.- малабарский. П. часто фальсифипи-руется как в зернах, так и в молотом виде. Красный стручковый П.: испанский П., или и а п р и к а,-плоды Capsicum annuum L. и С. longam D, С. и кайенский П.-плоды С. baccatum L. Испанский П. разводится в СССР на юге (в Крыму, на Кавказе и в других местах); в незрелом состоянии (зеленый) он употребляется для производства консервов (ф а р-ш и р о в а н н ы й П., см. Консервное дело), в зрелом состоянии (красный перец) применяется как пряность. Действующая составная часть паприки, так паз. к а и с а и ц и н C.gH gNOg,-вещество фенольпого характера, обладающее огромной едкостью. В кайенском Н. содержится больше капсаицина, почему он обладает еще более жгучим вкусом. Кроме перечислнпных видов к этой группе растений относятся также: бетель (Piper betle), листья к-рого (вместе с зернами пальмы Ареса catechu) жуют туземцы; к у-б е б а (Piper cubeba), зерна к-рого употребляются как пряность; пимент, или ямайски!! перец (Pimenta officinalis, сем. Myrtaceae), дающий плоды со вку- сом гвоздики, перца и корицы (рыночное название плодов- Allgewurz , allspice ). Лит.: Товароведение, под ред. П. П. Петрова и Ф. в. Церевнтинопа, т. 4, стр. 483-493, М., 1929; Тон-лрипп энциклопедия, под ред. В. Р. Вильямса и Ф. В. Церевитинова, стр. 913-9 15, М., 1927; М о е 1-1ог J., Mikroskopie d. Nahrungs- u. Genussmitlel aus d. Pflmz-nreiche. 2 Aufl., В., I905 Ф. Церевитинов. ПЕРИДОТИТЫ И ПИРОКСЕНИТЫ, общие лазвания глубинных изверженных горных пород, сложенных из темноцветных (мела-нократовых) минералов (оливин, пироксе-ны, первичная роговая обманка, биотит, шпинели) и рудных минералов (титаномаг-нетит, хромит, платина и платиноиды, сульфиды меди и никеля). Рудные минералы иногда скопляются в количествах, позволяющих промышленную эксплоатацию (м а г-матические рудные выделения). П. и п. образуются в результате или дифе-ренциации магм или ассимиляции магмой осадочных пород; уд. в. 3,2-3,4; структура кристаллическая средне- и крупнозерни-стая; цвет в общем темный (темнозеленый, темнобурый, вплоть до почти черного); форма залегания-глубинные массивы, лакколиты, батолиты; размеры значительно меньшие, чем гранитные интрузии. При выветривании эти породы образуют серпентины {змеевики); этот процесс сопроволодается образованием хризотил-асбеста и выделением железных руд и гидросиликатов никеля. В химич. отношении П. и п. характеризуются сравнительно небольшим содержанием SiOa (~40%) и AI2O3, значительным содержанием MgO (до 45%), FeO (до 17%), СаО (до 18%) и следами щелочей; характерно постоянное присутствие хрома и никеля. Ниже приведены анализы нескольких горных пород из групп П. и п.
1-ульхраогноиное габбро, Денежкпп Кчмень, Сев. Урал; 2-дунит, там же; 3-дунит, гора Дун в НоооП Зе.гг:1илии; 4-дунит, богатый магнетитом, KoiBHHcimfl Камень, Сев. Ура.ч; 5-верлтт, гора [ Кристал Фоллс, Мичиган, С. Америка; 6-пироксе-шгт, юра Биг-тау, р. Ентсей, Снбйрь; 7-Kocairr (с 0,58 сг2о3), р. Косва, Сев. Урал. Перидотиты состоят из оливина с тем или иным содержанием пироксенов (диопсид, бронзит, гиперстен, авгит, эгерин-авгит, ди-аллаг); при преобладании последних порода переходит в пироксениты. В зависимости от минералогич. состава различают следующие главные разновидности пород: дунит состоит прэимущественно из оливина; присутству- ют хромит и магнетит; верлит-из оливина и диаллага; косвит-то же с преобладанием диаллага; лорцолит-из оливина, диопсида, энстатита; гарцбургит-из оливина, бронзи-та, энстатита; роговообманковый перидотит включает зеленую или коричневую роговую обманку, слюдяной-биотит. При преобладании роговой обманки над оливином и пи-роксенами порода переходит в горнблендит. Диаллдгит, бронзитит, гиперстенит состоят преимущественно из какого-нибудь одного пироксена. Излившиеся на поверхность пе-ридотитовые и пироксенитовые породы образуют мелко- и среднезернистые, беспла-гиоклазовые (в отличие от оливиновых диабазов и мелафиров) породы-пикрит, пикри-товый порфирит, лимбургит, авгитит-породы черного или зеленовато-черного цвета. Лит.: л е в и н с в н-Л ессинг Ф.и Белянки н Д., Петрографич. таблицы, Л., 1927; О г Э., Геология, 3 изд., Москва, 1924; Мушкетов И.. Физич. геология, 3 изд., т. 1, Ленинград, 1924; Ш т и-ни И. и Мушкетов Д., Техническая геология, Л.-М., 1925. П. Топольницний. ПЕРИЛЛОВОЕ МАСЛО, жирное масло, получаемое из семян Perilla ociraoides (Индия, Китай, Япония), сем. губоцветных. В последние годы делают опыты культуры периллы в СССР (С. Кавказ). Семена содержат 40-45% масла; прессованием нол^-чают 32-33%. П. м. отличается горьким вкусом, к стеклу ке прилипает, собираясь в капли, теряет эту способность при нагревании до 250°. DJ2 = 0,928-0,934. Показатель преломления =1,4814-1,483 (20°). Число омыления = 1874-197; йодное число = 1804-206. Ге-ксабромное число = 514-64. Составные части П. м.: 12% насьпценных кислот (пальмитиновой и стеариновой), 4% олеиновой, 10% а-линолевой, 43% Д-линоле-вой, 20% а-линоленовой, 3% /5-линоленовой, 16,2% оксикислот. П. м. относится к высыхающим маслам; на воздухе поглощает кислород до 21-26% в 70-80 час; высыхает в течение 6 сут., применяется для олифоваре-ния. Олифа, приготовленная из П. м. с 3% свинцовомарганцевого резината, высыхает в течение 6 ч.; с 5% того же резината-в 4,5 ч. Лит.: Любарский, Маслоб.-жировое дело , М., 1926; там же, 1927, 9110; Иванов СЛ., там же, 1929. С. Иванов. ПЕРИОД функции, приращение аргумента, после к-рого повторяются значения периодич. ф-ии. В знаках: если при всяком t fit + T) = f{t), то Т-п е р и о д периодич. ф-ии f(t). Если t обозначает время, то и П. ф-ии обозначает промежуток времени между одинаковыми значениями периодич. ф-ии времени. Числом периодов в секунду (обозначение-пер/ск.) измеряется частота (см.) колебательного процесса, например переменного тока (см.). Технич. частоты последнего лежат в пределах 40-60 пер/ск.; в радиотехнике они значительно выше: 10-6 10* пер/ск. (см. Несущая волна). В английской и французской радиотехнич. литературе иер/ск. называется цикл, в немецкой герц. П. в астрономии употребляется в значении времени оборота планеты или кометы. ПЕРИОДИЧЕСКАЯ СИСТЕМА химич. элементов, классификация химич. элементов, предложенная в 1869 г. Д. И. Менделеевым в результате открытого им периодич, закона (см.). Менделеев положил в основу П. с. соотношения между ат. в. элементов и свой-ства.ми простых тел и образуемых элемента-жя соединений. Располагая элементы по воз-растаюшим ат, в. и замечая, что через каждые 7 элементов свойства их периодически повторяются, Менделеев распололшл все элементы в систему, к-рая первоначально состояла из 12 семичленных горизонтальных рядов. В дальнейшем по мере накопления фактич, материала, особенно же в связи с открытием явлений радиоактивности (см.) и рентгеновых лучей (см.), первоначальное построение системы видоизменилось, а с 1913 г., после работ Мозли, ат. в. в качестве основы классификации П. с. уступил свое место порядковому номеру. Подробнее см. Периодический закон. ПЕРИОДИЧЕСКИЕ ФУНКЦИИ, ф-ии, не меняющие своего значения при увеличении аргумента на постоянное число т, т. е. удовлетворяющие условию: / (ж + т) = / (ж) для всякого ж; т называется периодом. График П. ф. представляет неограниченное повторение одного куска кривой, перенесенного вдоль оси ж-ов на длину т, 2т,...,-т, , (см, фиг.). Если П. ф. имеет период т, то  числа 2т, Зт, т,. также являются периодами. Обыкновенно под периодом разумеют наименьший положительный период. Простейшие П. ф,-тригонохметрические ф-ии (см. Тригоножтрические функции); sin ж и cos ж имеют период 2л: sin (ж--2л)=sin ж, cos (ж-f 2л)=соз ж. Ф-ии sin пх и cos пх имеют период ~~ (наименьший); при п целом они допускают также период 2л. Это обстоятельство имеет большое значение для выражения произвольной П. ф.: произвольная П, ф, с периодом 2л, при нек-рых дополнительных условиях, м, б, представлена в виде ряда, содержащего постоянный член и члены с sinrtж, созпж (п=1, 2,3, ,.,) с постоянными коэф-тами (см. Гармонический анализ. Ряды Ф у р ь е), П, ф, имеют большое применение в физике и механике для описания периодич, процессов (колебаний); если яв.ле-ние имеет период Т, то основными П. ф, являются 8Ш-, С08--(1-независимое неременное, время; см. Маятник). После триго-нометрич, ф-ий важным классом П, ф, являются эллиптические, или двояко-периодические, функции (см. Эллиптические фугтции). Здесь рассматриваются также комплексные значения аргумента г; два периода 2а), 2сотоже, вообще гово- ря, комплексные; двоякопериодич, функции /( ) определяются условиями: f{z-{-2ca)=f{z), /(г-Ь2ш')=/(г). В последние годы датский математик Гаральд Бор изучил новый класс ф-ии-п о чти-п ериодические ф-ии. Их определение такс о: fix) является почти периодической ф-ией, если для всякого малого иолозкительного числа е можно найти такие числа т ( почти-периоды ), что для всех ж имеет место неравенство: /(ж -- т)-/(ж) < е; при этом разные почти-периоды, соответствующие данному е, л. б. расположены не реже нек-рой арифметич. прогрессии. Простейшими почти-периодич. ф-иями являются суммы П. ф. с несоизмеримым отношением периодов, напр. А 81паж-(-В sin /?ж, если иррациональное число. Доказывается, что любая почти-периодическая ф-ия м. б, представлена бесконечным рядам Фурье вида 2 (acos А„ж-Ь b sin Л„ж), где -любые дей- т1 = 1 ствительные числа (если А„ целые, то получим П. ф.). Почти-периодич. ф-ии встречаются в ряде проблем динамики. Лит.: Привалов и. и., Ряды Фурье, Москва- Ленинград, 1930. В. Степанов. ПЕРИОДИЧЕСКИЙ ЗАКОН, закон периодичности химических и физич. свойств элементов. Краткая формулиров1 а П, з. состоит в следующем: все химические и подавляющее болынинство физич. свойств элементов представляют собой периодич. ф-ию (прерывную) от величины за1яда атомного ядра. Закон этот был открыт Д, И, Менделеевым в 1869 г. и опубликован в том же году в первом томе Журнала русского физико-химич, общества, а также и за границей, В то время не существовало никаких представлений об атомном ядре, и Менделеев формулировал свой П. з, несколько иначе, а именно за аргумент взял вместо заряда ядра ат, вес и на основе своего постулата развил идею о естественной периодической системе элементов, разместив в ней отдельно элементы вполне правильно-в порядке возрастания ядерного заряда (см, табл,). При этом Менделееву, как известно, пришлось поступиться в трех случаях правилом постепенного нарастания ат, веса и поместить элемент с меньшим ат. весом после элемента с весом ббльшим. Список элементов, известных в настоящее время, обнаруживает четыре случая подобной аномалии атомных весов, В 1913 году Мозли заменил в формулировке Менделеевского закона ат, вес зарядом ядра, находящим непосредственное выражение в так наз, порядковом числе, или атомном номере, элемента. Своеобразный смысл понятия об ат, в, был раскрыт позднее работами Астона и Гаркин-са. Первые проблески понимания причин периодичности свойств элементов мы нахо-ди.м -в работах Дж, Дж, Томсона, но только И, Бор (1913) дал ясное толкование как строения электронных оболочек атомов, так и периодической системы элементов. Свое завершение идеи Бора получили в 1925 г. в принципе, высказанном Паули: в атоме не может существовать двух электронов. ПЕРИОДИЧЕСКИЙ ЗАКОН 2т Таблица элементов с изотопами нерадиоактивпых элементов. Название элемента Водород . Голий . . , Литий . . Бе]шллий Бор .... Углерод . Азот . . . Кислород. Фтор . . . Неои . . . Натрий . . Магний . . Алюминий Кремний . Фосфор . . Сера . . . Хлор . . . Аргон . . . Калий . . Кальций . Скандий . Титан . . . Ванадий . Хром . . . Марганещ. Железо . . Кобальт . Ниьель . . Медь . . . Цинк . . . Галлий . Германий Мьппьяк Селен . . . Бром . . . , KpniFFOH . Рубидий . Стронций . Иттрий . . Цирконий Ниобий (Ко лумПий). Молибден . Мазурий . Рутений . Родвй . . . Палладий . Серебро . . Кадмий . . Средний ат. в. Ат. в. изотопов Название элемента Средний ат. в.
114,8 118,70 121,76 127,5 126,932 130,2 132,PI 137,36 13b,90 140,13 140,92 144,27 150,43 152,0 167,3 159,2 162.46 163,5 167,64 169,4 173,5 176.0 178,6 181,36 184,0 186,31 190,9 193,1 195,23 197,2 200,61 204,39 207,21 209,00 210,0 225,97 (227) 232,12 (231) 238,14 At. B. изотопов 1121, 114k, 1151, U3C, 117f, 118b, 119e, 120a, 12 Ш, !22g, 124d 121.1, 123b r<?6b,128a, 130c, 127 1241, 126h, 128f, 129;i, 130g. 131c, 132b, 134d, 136e 133 (1.36b), 138a 140a, 142b 141 142, 144, (145), 146 182, 183, 184, 186 185b, 187a 186e, 187 f, 188d, 189c, 180b, 192a 198d,199C, 200b, 20le, 202a, 2041 206b,207c,208a, (2U9) Изотопы радиоактивных элементов-см. Спр. ТЭ, т. I. Буквы при ат. в. изотопов указывают содержание того или иного изотопа в составе элемента (а-наибольшее, Ь-меньше и т. д.). имеющих совершенно идентичные квантовые числа . Этот принцип позволил теоретически объяснить структуру периодической системы. В настоящее время в связи с дальнейшими успехами науки (волновая механика, новое учение Лондона о валентности, новые экспериментальные данные) П. з. может быть истолкован еще глубже и продолжает служить путеводной нитью для исследователей свойств вещества. Попытки классификации элементов делались и до Менделеева: Доберейнер (1829 г.) установил закон триад, по которому аналогичные (по свойствам) элементы м. б. сгруппированы по три в триады , причем ат. в. среднего члена такой группы близок к полусумл1е ат. в. крайних элементов; эту идею далее развивали Петтенкофер, Дюма. Значительно ближе к П. з. подошел Шанкуртуа (1826 г.), еще ближе Ньюландс (1865 г.) в своем законе октав. Менделеев расположил все известные ему химич. элементы в порядке возрастания ат. в. и отметил, что в таком ряду периодически повторяются аналогичные серии элементов, т. н. периоды. Если написать один период под другим, то в отдельные вертикальные столбцы, названные Менделеевым группами, попадают элементы, аналогичные по своим физич. и химич. свойствам. Заметив, что целый ряд элементов не укладывается в систему, если им приписать ат. в., общепринятые в то время, Менделеев признал необходимым исправить эти веса. Так, для элемента индия принимался в то время ат. в. 75,4 (37,7 х 2, т. к. индий считали двухвалентным элементом но нек-рому сходству с цинком); однако в ряду Менделеева место для элемента с ат. в. в 75 занято мышьяком: IV гр. V гр. VI гр. Ge As Se 72,5 74,96 79,2 Ясно, что ат. в. индия не м. б. равен 75,4; остается предположить, что валентность индия равна не двум, но трем или четырем, и ат. в. его тогда будет соответственно 37,7 х хЗ=113 или 37,7x4=151. Предположив, что индий трехвалентен, Менделеев нашел для него место в системе между кадмием (ат. в. 112) и оловом (ат. в. 119) и т. о. указывал на необходимость и*кать аналоши индия не с цинком (II группа), но с алюминием (III группа),что при дальнейшем исследовании вопроса оправдывается. Подобным путем были исправлены или установлены Менделеевым ат. в. индия, урана, платины, осмия, иридия, золота, титана, бериллия, церия, иттрия. Д. И. Менделеев не остановился на исправлении ат. в. элементов известных. Ему принадлен^ит также предсказание новых, тогда еш;е неизвестных, элементов со всеми их важнейшими физич. и химич. свойствами. Предсказаны были аналог бора- экабор, аналог алюминия - экаалюмпний, затем экасилиций, экатантал, экамарганец и двимарганец, экацезий и экаиод. Из этих 8 элементов первые шесть теперь уже открыты и названы: скандий, галлий, германий, протактиний, мазурий и рений. Как близко совпадение между свойствами элементов, предсказанных Менделеевым и фактически открытых, видно из следующего сопоставления: Предсказано Д И. Мен- Найдено К.т. Винклером делеевым в 1871 г. в 1886 г. -Экасилиций . Es Германий . . Ge At. в. . . . 72 At. в. . , . 72,5 Уд в. . . . 5,5 Уд. в. ... 5,469 Ф-ла окисла EsOa Ф-ла окисла беОг Уд. в. окисла 4,7 Уд. в.окисла 4,703 Хлирист )е Хлормстое соединение ЕзСЦ соединение GeCl* (° m. . lUO t-Kun. 86° Уд. в. . . . 1,9 Уд в. . . . 1,887 Металлоор- Металлоор-ганич.соеди- ганич.соединение .... Es(G2H5) некие . . . GeCCaHe)* trtm. - 160° t\ n,.... 160° Уд, в. ... 0,96 Немного легче воды Весь фактич. материал химии, представлявший ранее бессистемное скопление разрозненных данных, получил на основе П. з. новое освещение и бьы систематизирован; блестящие обобщения, предсказания, новые пути исследования и выше всего сама философская идея о существовании естественной системы элементов, о существовании закона, подчиняющего себе многообразие элементов,- вот вклад в науку, обессмертивший имя Д. И. Менделеева, В 1870 г. германский химик Лотар Мейер, уже знакомый с открытием Менделеева, опубликовал статью, в к-рой дал кривую атомных объемов, особенно ярко подчеркнув этим с количественной стороны идею периодичности физич. свойств химич, элементов (фиг, 1), Открытие периодической системы элементов дало химии мощный толчок вперед, но самый принцип построения системы, причина периодичности химических и физических свойств оставались тайной до недавнего времени. Только успехи физики, разгадав- шей природу рентгеновьгх л^ей и линейчатых оптических спектров, позволили в настоящее время дать истолкование этой системе. С современной точки зрения каждый нейтральный материальный атом состоит из равного количества частиц положительного электричества (протоны) и отрицательного электричества (электроны). Все протоны данного атома и некоторая часть его электронов (цементирующие электроны) составляют ядро атома; вокруг ядра, лежащего в центре атома, расположена электронная с ф е р а, т. е, пространство, заключающее в себе все остальные (иногда называемые планетарными) электроны, Т. к, заряды протонов и электронов равны друг другу по величине и только противоположны по знаку, заряд ядра равен всегда разности между числом его протонов и цементирующих электронов, умноженной на элементарный заряд (4,77 10~ абс, эл.-ст. ед,);  10 iO so 70 90 по 130 150 ТУО ГЯв Ш iiO Фиг, 1. число планетарных электронов конечно также равно этой разности, т, е, равно числу свободных полол^ительных зарядов ядра. Масса ядра приблизительно . равна сумме масс его протонов, а т. к, масса ядерного протона, выраженная ь шкале ат, в., близка к единице, следовательно и вес ядра в той же шкале равен числу входящих в него протонов; электроны имеют малую массу, приблизительно в 1 842 раза меньшую, чем масса одного протона, а потому массу цементирующих электронов можно в первом приближении не принимать во внимание; то же можно сказать и про планетарные электроны. Таким образом ат, в, в первом приближении д, б, равен числу протонов, входящих в ядро атома, В 1913 году Мозли, изучая рентгеновы спектры элементов, нашел основной закон, согласно к-рому положительный заряд ядра (а следовательно и число планетарньгх электронов) атомов данного элемента есть величина вполне определенная и равная порядковому номеру элемента в таблице Менделеева. Т. о. положительный заряд ядра первого по порядку элемента-водорода-равен заряду одного протона, а так как ат. в. водорода равен 1, то в водородном ядре очевидно присутствует только один протон и нет совсем цементирующих электронов; ф-ла водородного атома будет где р, стоя- щее в квадратных скобках, обозначает ядро, состоящее из одного протона, а е есть единственный планетарный электрон. Формула кальциевого атома будет [peje*, так как атомный вес кальция равен 40, а порядковый номер-20. Заряд ядра последнего элемента таблицы урана оказался равным 92; на этом основании можно утверждать, что согласно закону Мозли и порядковый номер урана тоже равен 92, т. е. между водородом и ураном в системе должно стоять ровно 90 элементов. Мы пе знаем до сих пор, продолжается ли система дальше урана, т. е. сушествуют ли в природе атомы тяжелее и сложнее урана, имеющие заряд ядра в 93, 94 и т. д. единиц, но если принять уран за последний элемент, общее число их будет равно 92. Из этих 92 элементов в настоящее время только два остаются еще неоткрыты- 6 <
риод-самый большой (радоновый)-содержит 32 элемента; от седьмого периода мы знаем лишь обрывок из шести элементов. Вышеупомянутые числа 2, 8, 18 и 32, характеризующие длины периодов, укладываются в простые ф-лы вида: 2 1 = 2; 2 2* = 8; 2 32 = 18 и 2 42 = 32, на что указал еще Ридберг. Т.о. мы видим, что .химич. характеристика элелтентов меняется в ряду элементов, расположенных в порядке возрастания ядерного заряда, действительно периодически: после некоторой серии химически активных элементов в системе периодически появляются инертные элементы, причем порядковые номера этих последних подчинены стро! ому математическому правилу. В первом периоде мы имеем один активный элемент водород и один инертный- гелий; в последующих периодах мы имеем опять по одному инертному элементу (в совокупности они дают семейство инертных газов), но число активных возрастает: во втором и третьем периоде их по семи, в четвертом и пятом по 17, в шес- Фиг. 2. ми, а именно экацезий и экаиод, предсказанные еще Менделеевым, Выше приводится таблица элементов с сохранением способа написания ее, предложенного Менделеевым; наиболее существенным дополнением к форме таблицы является включение в клетку каждого элемента наряду с ат. весом порядкового числа, равного заряду ядра. Как видно из вышеприведенной таблицы (фиг. 2), вся периодическая система элементов состоит из семи периодов. Шесть пе[)вых периодов кончаются инертными газами: Не, Ne, Аг, Кг, X, Rn; седьмой период, не законченный, имеет последним элементом уран. Первый период-гелиевый - состоит из двух элементов: водорода п гелия; второй и третий периоды (неоновый и аргоновый), или т. н. малые периоды, состоят каждый из 8 элементов; четвертый и пятый (криптоновый и ксеноновый), т. н. большие периоды, содержат по 18 элементов; шестой пе- тивных элементов второго (неонового) периода резко отличаются друг от друга и являются первыми и наиболее типичными представителями семи семейств, составленных аналогичными по своим свойствам элементами; эти семейства следующие: I семейство одновалентных щелочных металлов (Li, Na, К, Rb, Cs, EkCs), II семейство двухвалентных щелочноземельных металлов (Be, Mg. Ca, Sr, Ва, Ra), III семейство трехвалентных бора и земельных метал лов (В, А1, Ga, In, Tl), IV семейство четырехвалентного углерода (С, Si, Ge, Sn, Pb), V семейство пя-тивалрнтиого азота (N, Р, Аз, Sb, Bi), VI семейство кислорода (О, S, Se, Те, Ро), VII семейство галогенов (F, С1, Вг, J, EkJ). Т. о. к 7 активным элементам 2-го периода примыкают в качестве химич. аналогов все 7 активных элементов третьего периода, а из последующих 4-го, 5-го и 6-го периодов тоже только по семи элементов; этот факт подчеркнут нами в таблице тем, что символы аналогичных элементов поставлены точно один под другим в вертикальный столбец. Одна из главных аналогий между членами каждого отдельного семейства - одинаковая высшая валентность по кислороду; высшая валентность всех аналогов углерода равна четырем и по отношению к кислороду и по отношению к водороду; высшая валентность аналогов азота по кислороду равна 5, по водороду 3, в семействе кислорода соответственно 6 и 2, для галогенов 7 и 1 и т. д. Эти аналогии находят свое символическое изображение в таблице в виде ф-лы высших окислов и водородных соединений, приписанных к каждому вертикальному столбцу. Каждая горизонтальная серия из семи активных элементов начинается электроположительным щелочным металлом, кончается электроотрицательным галогеном. В больших периодах (4-м и 5-м) между щелочноземельным металло-м и земельным поменщет-ся декада металлич. элементов нового типа: 4-f! период: КСа [Sc Ti V Сг Мп Fe Со NiCu Zn] Ga Ge As SeBrKr; 5-Й период: Rb Sr( Y Zr Nb Mo MaRuRhPd AgCd] In Sn Sb Te ,T X. Если элементы, стоящие до и после скобки, являются аналогами элементов 2-го и 3-го периодов, то декады, заключенные в скобки, представляют собой серии нового типа, причем вставная декада 5-го периода аналогична декаде периода 4-го, т. е. элементам ряда Sc-Zn. Точно такую же вставную декаду мы находим и в 6-м периоде, но там она осложнена тем, что между первым и вторым членом декады в свою очередь вставлена еще новая серия т. н, редкоземельных элементов, состоящая из 14 членов. Т. о, строение 6-го периода можно представить так: Cs Ва (La [Се Рг Nd II Sm Eu Gd Tb Dy Ho Er Tu Yb Lu] Hf Та W Re Os Ir Pt Au Hg) Tl Pb Bi Po EkJ Rn, 8 элементов 6-го периода являются аналогами 8 представителей 2-го и 3-го периодов, 10-аналогами элементов соответственных вставных декад 4-го и 5-го периодов, а остальные 14 представляют собой новую своеобразную серию металлов, не имеющую аналогов в вышележаищх периодах системы, 7-й период м, б, представлен так: EkCs Ra (Ac Th Pa U,.,), т. e. кроме двух типичных щелочного и щелочноземельного металлов мы имеем еще 4 члена, представляющих как бы начало вставной декады, т, к. действительно элементы Ас-U сходпы с элементами La-W, Y-Mo, Sc- Cr, По аналогии с 6-м периодом можно было бы ожидать между Ас и Th вставку из 14 аналогов ряда Се-Lu, но на самом деле это не имеет места. Хотя появление металлов вставных декад представляет собою новое развитие идеи химич. активности, а не простую вариацию типичных элементов малых периодов, тем не менее ббльшая часть из них м, б. раз.меще-на в те же 7 групп, которые были нами указаны. Мы могли бы ожидать, что вставленная между двухвалентным кальцие.м и трехвалентным галлием декада металлов будет состоять из металлов двух- или трехвалентных со свойствами, промежуточными между кальцием и галлием. На самом же деле мы имеем вслед за двухвалентным кальцием сразу трехвалентный скандий, зате.м четырехвалентный титан, пятивалентный ванадий, шестивалентный хром и семивалентный марганец; т. е. природа здесь, хотя и в иной форме, но имитирует до известной степени ход валентности в малых периодах. Элементы конца вставной декады Си и Zn также примыкают по некоторым своим свойствам к типичным элементам I и 11 групп системы, но железо, кобальт и никель не имеют даже отдаленных аналогов в малых периодах, и Менделееву пришлось их поместить в особую, VIII группу; этот фактг подтверждает мысль об исключительном положении всех элементов вставной декады и о пек-ром сомнении в правильности помещения нек-рых ее членов в один столбец с элементами малых периодов. О том же говорит особенпое, свойственное элементам вставных декад, свойство-давать комплексные соединения, яркая окраска ионов, образуемых этими элементами, магнитные их свойства и многие другие своеобразные проявления их природы, отличающие вставные декады от типичных элементов. Еще болев' своеобразна и исключительна по своим особенностям группа 14 элементов редких земель; свойства этих элементов близки друг к другу, и вследствие этого их разделение и очистка весьма затруднительны. Т. о. в системе элементов мы можем отличать следующие составные части: 1) два простейших элемента-водород и гелий, составляющие первый период; 2) 42 типичных элемента (2-й и 3-й периоды и их аналоги из последующих периодов), дающие 8 вертикальных столбцов или групп от О до VII; 3) 34 элемента вставных декад, помещенных в те же вертпкальные столбцы от I до VII, а также в особую VIII группу. 25 из них^ попадая в вертикальные группы, образованные типичными элементами, составляют т. н, побочные подгруппы: 1а-благородные металлы Си, Ag, Au; Па-подгруппа пинка Zn, Cd, Hi:; Ilia-подгруппа скандия Sc, У, La, Ac; IVa-подгруппа титана Ti, Zr, Hf, Th; Va - подгруппа ванадия V, Nb, Та, Pa;: Via-подгруппа хрома Сг, Mo, W; Vila- подгруппа марганца Mn, Ma, Re, VIII группа составлена тремя триадами: Fe, Со, Ni;. Ru, Rh, Pd и Os, Ir, Pt; 4) наконец в системе имеем еще 14 металлов редких земель. Сложное строение системы долгов время было загадкой и только после успехов физики, выяснившей на основе изучения спектров структуру электронных оболочек атомов, установлены были принципы, лежащие в основе явления периодичности. Прежде всего было выяснено, что состояние каждого планетарного электрона, рассматриваемого отдельно от остальных электронов атома, м, б, охарактеризовано четырьмя символами-т, н, квантовыми числами - соответствепно числу независимых периодич, движений или числу степеней свободы данного электрона; три из них отвечают трем пространственным ко-ордшьатам (в первоначальной теории Бора этому отвечали три одновременных движения: враи1ение электрона по орбите, вращение самой орбиты в известной плоскости вокруг ядра атома и наконец прецессионное-вращение этой плоскости), четвертое связано с вращением электрона вокруг его собственной оси. Эти четыре числа п li, li и s, связаны между собою следующими законами-: О < li < rii-l. Периоды Li-Ne Na-Аг Принимая во внимание эти математич. ограничения,а также высказанный в 1925 г. Паули принцип, согласно к-рому в атоме не может существовать двух электронов, для которых все 4 квантовые числа совпадали бы, мы можем вычислить, сколько электронов, отвечающих главным квантовым числам Пг = 1, 2, 3, ... , может поместиться в 1-й, 2-й, 3-й,... электронной оболочке, или сфере, окружающей ядро атома. По вычислению оказывается, что в первой сфере м.б. максимум 2 электрона, во второй 8, в третьей 18, в четвертой 32, н получаем ряд чисел, характеризующий Д.ЧИНУ периодов системы элементов, причем 8 электронов, имеющих Пг= 2, разбиваются на 2 подгруппы: для 1,-=0 мы имеем два электрона (1= О, Si = ± для г, = 1 имеет уже шесть электронов (1, = +1,0 и -1 и в каждом случае = ± М . Далее 18 электронов третьей сферы разбиваются на три подгруппы, имеющие различное второе квантовое число 1;: в одной из них 2 электрона, в другой 6, в третьей 10; 32 электрона 4-й сферы делятся соответственно на подгруппы в 2, G, 10 и 14 электронов. Эти числа играют, как оказывается, решающую роль в построении периодической системы. Проходя в системе от первого элемента по порядку до последнего, мы все время имеем возрастание заряда ядра, а следовательно и числа планетарных электронов, к-рые и будут размещаться вокруг ядра, согласно принципу Паули; при этом, как можно показать теоретически, законченному постройкой слою из 8 электронов (2-1-6), а в случае гелия слою из двух электронов (Пг = 1) отвечает атом со свойствами инертного газа. Строя электронные оболочки вокруг ядра, мы должны периодически закапчивать одн^ и приниматься за постройку следующей, более внешней (увеличение П{ на 1); в этот момент мы и будем иметь конец периода, характеризуемый появлением инертного газа. Водород и гелий отвечают постепенному заполнению 1-й электронной сферы на протяжении периода Li-Ne, заполняется 8 электронами 2-я сфера, период Na-Аг отвечает постепенному заполнению 8 электронами 3-й сферы, которая согласно сказанному может содержать в Себе не 8, а 18 электронов. Дальнейший ход заполнения электронами пространства вокруг ядра ясен из следующей схемы (см. схему строения электронных оболочек), в которой римскими цифрами изображены последовательно заполняемые электронные сферы; арабские пифры представляют со-ою число новых электронов, попадающих в атом и размещающихся в том или ином слое; (см. Строение атома). Из этой схемы ясно, что типичные элементы сходны между собой вследствие одинако-аой структуры самого внешнего электрон- Схема строения электронных оболочек. 2 6 2 6 10 Г 2 6 10 14 1 2 6 10 2 b 10 2 в 2 6 1 2
НОГО слоя (последовательное заполнение его 8 электронами); металлы вставных декад отвечают вхождению 10 электронов во II слой снаружи; тметаллы редких земель соответствуют накоплению 14 электронов в III снаружи слое (IV слой при наличии более внешних V и VI). Современная теория валентности (Лондон) основана на представлении о непарных электронах, не имеющих внутри атома партнера, обладающего теми же самыми первыми тремя квантовыми числами и отличающегося только знаком четвертого квантового числа (вращение электрона вправо или влево обозначается символами ± 1 Приложение этой теории к системе элементов объясняет как периодичность валентности, так и многие другие ее особенности, напр. низкую валентность кислорода и фтора. Во всех случаях периодичности физич. и химич. свойств элементов в основе лежит факт периодичных изменений внешней электронной оболочки, имеющих место при рассмотрении элементов, расположенных в ряд Менделеева. От структуры внешней электронной сферы зависит, каким образом атом реагирует на воздействия внешней среды. Свойства центральной части атома не отражаются непосредственно на явлениях, происходящих на его поверхности. Существуют однако явления, зависящие как-раз от ядра атома и не связанные тесно с его периферией ;сюда относятся явления радиоактивности и вообще весь комплекс проблем, касающихся прочности ядер, их синтеза и дезинтеграции. Рассматривая эти явления, мы уже не можем ждать периодичности или во всяком случае закон периодичности будет иной, никак не связанный со структурой электронных оболочек, но зависящий от строения ядер. Гаркинс первый указал на то, что повидимому существует особая периодичность и для ядерных свойств, но период, открытый им, оказался равным не 8 и не 18, а всего только 2; на протяжении всей системы четные по порядку элементы оказались более распространенными в при- роде, чем нечетные; число изотопов (см.) у четных элементов значительно и веса их большей частью четны. Нечетные элементы мало распространены в природе, число изотопов у них не превышает двух и за редкими исключениями веса их нечетны. Таким образом, проходя через систему, мы попеременно будем встречать элементы с более прочными и менее прочными ядрами. Тем же Гаркинсом была высказана идея о потере массы, происходящей при образовании тяжелых атсмов из водорода благодаря громадному экзотермическому эффекту. Астон, изучавший отклонения масс отдельных атомов от це.аых чисел, составил в 1930 году таблицу этих отклонений и на основании ее пришел к заключению, что наибольшая потеря массы, а следовательно и наибольший экзотермич. эффект образования, отвечает элементам, лежащим в системе около железа. Этот факт, возможно, и объясняет большое распространение в природе железа. Т. о. периодическая система, построенная на основании данных о периферических свойствах атомов, в настоящее время начинает служить и выяснению проблемы эволюции материи. Система Менделеева оказалась не искусственной классификацией элементов, а естественной системой их; она послужила и долго будет служить источником рабочих гипотез, путеводной нитью исследователя. Лит.: Менделеев Д., Основы химии, 9 изд., т. Z, М.-Л., i9.;8; Хвопьсоп О. Д., Фичнка наших дней, 2 издание, М.-Л., 1929; Бор Н., Три статьи о спектрах и строении атомов, пер. с нем., М.-И., 1923; Крамере Г. А. и Го льет X., Строение агома и теория Бора, пер. с англ., М.-Л., 1926; Чу га ев Л., Периодич. система химических алемеитои, Москва, 1913; Спр. ТЭ, т. I, стр. 45-55; Л1 е у е г L. и. Л1 е н d е 1 е j е t f D., ADliandlun-йеп uber d. natiirliclie System d. cliemisciien Elemente, Ostwalds Kldssiker d. exakten Wissensctialten, 68, Leipzig, 1895; E иск en A., Lelirbucu d. ciiemischeu Puysik, Leipzig, 1930; S с b ra i d t K., Das perio-discbe System d. cbemiscben Elemente, Lpz., 1917; U a b 1 n о w i t z E. u. T b i e 1 o, Das periodische System d. Elemente, Stg., 1930. C. Щунарев. ПЕРИСКОП, оптич. прибор, дающий возможность рассматривать предметы, расположенные в горизонтальных плоскостях, не совпадающих с горизонтальной плоскостью S,--------- Фиг, 1. глаза наблюдателя. Применяется на подводных .лодках для наблюдения за поверхностью моря при погруженном состоянии лодки, в сухопутной армии-для безопасного и не- Фиг. 3. :/. э заметного наблюдения за противником из защищенных пунктов, в технике-для исследования недоступных внутренних частей изделий. В простейшей форме П. состоит из вертикальной трубы (фиг. 1) с двумя наклоненными под углохм в 45° зеркалами Si и или призмами с полным внутренним отражением, расположенными параллельно друг другу в разных концах трубы и обращенными друтк другу своими отражающими поверхностями. Однако отражательная система П. молсет конструироваться различно. Система из двух параллельных зеркал (фиг. 2а) дает прямое изображение, правая и левая стороны которого идентичны с со-ответствующихми сторонами наблюдаемого предмета. Система из двух перпендикулярных зеркал (фиг. 26) дает изображение обратное, и т. к. оно рассматривается наблюдателем, стоящим спиною к предмету,то правая и левая стороны меняют свои места. Перевертывания изображения и смещения сторон легко достигнуть, помещая в систему преломляющую призму, но необходимость наблюдения спиною к предмету, а следовательно и затруднительность в ориентировке остается, и поэтому вторая система менее пригодна. Недостатками П.,изображенного на фиг. 1 и при.меняемого в позиционной войне, являются незначительный угол зрения а (ок. 10-12°) и небольшая светосила, что вынуждает ограничиваться длиною не более 1 ООО мм при сравнительно большом диаметре трубы-до 330 лш. Поэтому в П. отражающая система обычно связывается с системою линз. Это достигается присоединением к отражательной системе П. телескопа, одного или двух. При этом т. к. обычная астрономич. труба дает обратное изображение с перемещенными сторонами, то комбинация перпендикулярных зеркал с такой трубой даст пря.мое изобразкение с правильно расположенными сторонами. Недостатком такой системы является положение наблюдателя спиной к предмету, о чем упомянуто выше. Присоединение астрономич. трубы к системе параллельных зеркал также нецелесообразно, т. к,изображение получится перевернутым, с обращенными сторонами. Поэтому в П, обычно соединяются система параллельных зеркал и земная зрительная труба, дающая прямое изображение. Однако установка двух астрономич, труб после двух инверсий даст также прямое изображение, почему также применяется в П, Трубы в этом случае располагаются объективами друг к другу. Преломляющая система П, не представляет каких-либо особенностей по сравнению с телескопом, однако выбор той или иной кол1бинации телескопов (точнее линз), их количества и фокусного расстояния определяется требуемыми углом зрения и светосилой П, В лучших П, яркость изображения уменьшается - на 30% в зависимости от системы и сорта липз. Г, к. отчетливость изображения зависит и от окраски предметов, то улучшение видимости достигается также применением цветных светофильтров. 1 ... 8 9 10 11 12 13 14 ... 48 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© 2007 SALROS.RU
ПромСтройМат |