 |
 |
 |
 |
1 2 3 4 5 ... 49 или на гидрат закиси олова. Довольно прочны, однако легко окисляются, переходя в соединения четырехвалентного олова. Благодаря последнему обстоятельству они являются сильными восстановителями. Ацетат олова, ста нн о ацетат, 8п(С2Нз02)2, уксуснокислая соль закиси олова, получается при действии уксусной кислоты на закись олова или на гидрат закиси олова, а также при обработке раствора SnCla раствором уксуснокислого натрия или калия. Приготовляется также путем обработки раствора SnC в горячей уксусной кислоте уксуснокислым раствором свинцового сахара. При осаждении водных растворов спиртом образует маленькие бесцветные кристал.т1Ы, Гил. 182°. Применяется обычно в качестве протравы при крашении и ситцепечатании. Оксалат олова, станнооксалат, щавелевокислая соль закиси олова, SnC204. Получается при действии растворов щавелевокислых солей щелочных металлов на раствор SnClg или при растворении свежеосаж-денного гидрата закиси олова в щавелевой к-те. Уд. вес 1)2 =3,56. Применяется в качестве протравы в ситцепечатании и крашении тканей. Сульфат олова, SnSO, по-яучается при взаимодействии свежеосажденной SnO с разбавленной H2SO4 При нагревании. Бесцветные кристаллы в виде игол или листочков с жемчужньпл блеском. В 100 ч. воды при 19° растворяется 18,8 ч. SnS04, при 100°- 18,1 ч. При стоянии водных растворов из них выделяется основная сернокислая соль. Сульфид олова, сернистое олово, SnS. Безводное соединение приготовляется путем сплавления олова с серой и возгонки получаемого продукта в токе водорода в нагреваемой до яркокрасного каления фарфоровой трубке. Водный SnS получается при продолжительном пропускании HS в слабо подкислен, растворы солей Sn . Возогнан-ный SnS-ромбоэдрич. синевато-серые кристаллы с металлич. блеском, 1°пл. 880°, уд. вес В^°=Ъ,08. Осажденный водный SnS - аморфный порошок темнобурого или черного цвета. В конц. НС1 сульфид олова растворяется; под действием содержащих свободную серу растворов сернистых щелочных металлов и сернистого аммония образуются растворимые соли тиооловянной к-ты, напр.: SnS + S + (NH4)2S = (NH4)2SnS3. - Хлористое олово, полухлористое, однохлористое олово, SnClg 2 HgO получается при действии на металлич. олово хлористого водорода или теплой конц. соляной к-ты. Процесс идет быстрее, если олово содержит примеси, а также в присутствии металлической платины. Продукт подвергают перегонке после прибавления к нему новой порции олова и оставляют кристаллизоваться. Из растворов SnClz 2 HgO выделяется в виде бесцветных столбчатых кристаллов моноклинной системы, уд. в. D 5= 2,71. На воздухе они не расплываются, но хорошо растворяются в воде (при 15° 1 ч. на 0,37 ч. воды) и в спирте. При нагревании до 100° или в вакууме они легко отдают воду. При действии на SnCl2-2H20 газообразного НС1 получается жидкость, которая имеет состав SnCl2-HCb3HoO удельн. веса 2,2 и затвердевает при -27°. Безводное SnCl2 получается при медленном нагревании SnCl22H20. Сперва дигидрат становится жидким, растворяясь в кристаллизационной воде, потом тестообразным, затем он твердеет и наконец плавится. После охлаждения его перегоняют в особых ретортах; получающийся при этом продукт представляет собою просвечивающую кристаллич, массу с раковистым изломом и плавится при i° 246,8°, образуя маслянистую жидкость; 606°. Растворяется кроме воды вспирте,эфире,ацетоне, уксусно-этиловом эфире и пиридине. В твердом состоянии SnCl2 устойчиво на воздухе. Разбавленный водный раствор SnClo подвергается частичному гидролизу, причем выделяется белый порошкообразный осадок основной хлористой соли Sn : SnCl2 + Н2О Sn(OH)Cl + HCl. Наряду с этим процессом под влиянием кислорода воздуха происходит частичное окисление SnCla в SnCli: 6SnCl2 + 2Н2О -I- 022SnCl4 +4Sn(0H)Cl. В сильно подкисленном растворе происходит только образование SnCl4: 2SnCl2 + 4НС1 + 02- 2SnCl4 + 2Н2О. Окисление м. б. предотвращено прибавлением к раствору SnClg металлического олова. Комплексные соединения SnClg представляют собою б.ч. соли к-ты состава HaSnClj, напр.: K2SnCl4.H20 или SnCl, 2 КС1 HgO; (NH4)2SnCl4-H20 или SnCl2-2NH4Cl; и т. д. Большая восстановительн. способность SnCl2 обусловливает его широкое применение в лабораторной и производственной практике. При помощи SnCla производится восстановление HNO3 в окислы азота, в гидроксил-амин и аммиак, соединений Fe * в соединения Ре ,хроматов в соединения окиси хрома, ман-ганатов в соли Мп , нитросоединений в амины, солей диазония в гидразины и т. д. Этими реакциями часто пользуются для количественного определения соответствующих соединений. Во многих случаях SnClj применяется для протравливания и закрепления красок в ситцепечатании и при крашении хлопка, шелка и шерсти и служит для приготовления оловянных композиций (оловянных растворов), употребляемых для оживки при крашении ализарином, кошенилью и т. п. Им часто пользуются также в качестве катализатора при хлорировании и конденсирующего средства. Кроме того SnCU служит во многих случаях исходным веществом для получения других соединений Sn, напр. ацетата, окиси, хлорного олова и т. д. Употребляется также при лужении, бронзировании, при получении сплавов олова с цинком, в качестве усилителя фотографич. снимков и т. д. При действии SnClg на хлорное золото, AuClg, получается красный осадок, называемый кассиевым пурпуром и употребляемый для ойрашивания фарфора и стекла в красный цвет. В качественном химич. анализе SnCla служит для определения железа. Раствор SnClg в НС1, называемый беттендорфовым реактивом (Solutio stanni chlorati), употребляется для определения присутствия мышьяковой и мышьяковистой кислот путем их восстановления в металлич. мышьяк. Для приготовления этого раствора или растирают 5 ч, SnClg с 1 ч, соляной к-ты уд. в. 1,124-1,126 в кашицу, которую затем насыщают сухим НС1, или обрабатывают соляной к-той (20ем, уд. в, 1,124) смесь 25 ч, SnClg с 150 см эфира. Испытываемая на мышьяк жидкость обрабатывается 5 см соляной кислоты, потом 5 см описанного раствора встряхивается и на несколько минут погружается в пробирке в воду, имеющую t° 40°. Цитрат олова,лимоннокислое олово, (CgHgOyJaSna, представляет собою хорошо действующую протраву при крашении желтыми красителями. Тартрат олова, виннокислое олово, CiHOeSn, получается при действии на раствор SnCla виннокислых со.71ей К или Na, а также при обработке винной к-той свежеоса-жденного гидрата закиси олова. Применяется в качестве протравы при крашении тканей и ситцепечатании. Соединения четырехвалентного Sn. Вследствие того, что металлоидные свойства четырехвалентного Sn выражены более ярко, чем металлические, соединения четырехвалентного Sn б. ч, представляют собой непрочные вещества, в к-рьгх Sn входит в состав анионов. Растворы этих веществ легко подвергаются гидролизу, образуя оловянные кислоты. Дисульфид олова, двусернистое олово,8п82. Аморфный SnSg получается при действии HgS на слабо кислый раствор SnCli; осадок последовательно промывается водой, спиртом и эфиром и быстро высушивается в вакууме. Аморфный SnSg-желтая масса, нерастворимая в слабых к-тах и растворяющаяся в NH4OH, в растворах соды и едкого натра, Конц, HNO3 окисляет его в -оловянную к-ту. При окислении SnSg на воздухе получается SnO 2, Под действием растворов сернистых щелочных металлов и сернистого аммония образуются растворимые соли тио-оловянной (сульфооловянной) к-ты, напр, сульфооловяннонатриевая соль, NagSnSs- 2Н2О, кристаллизующаяся в бесцветньгх октаэдрах, Кристаллич. SnSa-блестящие желтые чешуйки или листочки, к-рые наошупь кажутся мягкими и жирными, уд, в, D°= 4,5; при нагревании они становятся темно-красными или почти черными и вновь приобретают желтую окраску по охлаждении. При сильном нагревании происходит разложение наSnS и S. Азотная к-та при кипячении, а также растворы сернистых щелочных металлов не действуют на кристаллич, SnSo. Под действием царской водки оно превращается в SnCli, причем выделяется сера. Удобнее всего кристаллич. SnS г переводится в раствор путем сплавления с содой и серой. В виде сусального золота (см. Оловянные краски) SnS2 применяется для золочения. Сульфат четырехвалентного олова, сернокислая соль окисного олова, Sn(S04)a 2 Н2О, получается путем растворения свежеосажденной а-оловянной к-ты в кипящей разбавленной H2SO4. Раствор выпаривают и получают Sn(S04)2-2420 в виде бесцветных кристаллов; они легко растворяются в разбавленной H2SO4. Под влиянием прибавления значительных количеств воды происходит разложение сульфата, причем выделяется студнеобразный осадок. Хлорное олово, четыреххлористое олово, Spiritus fumans, Libavib, оксиген-ная соль, SnCl4. Получается путем пропускания тока сухого хлора над расплавленным оловом и перегонки полученного продукта. В технике значительные количества SnCl4 получают путем действия сухого хлора на обрезки белой жести. Предложен также способ приготовления SnCl, путем пропускания смеси одинаковых объемов СО и Clg при высокой t° над смесью равных количеств SnO2 и древесного угля (R, Steiger, Г, П. 222838). В случае содержания примесей железа продукт перегоняется с концентр. H2SO4, Хлорное олово-бесцветная, дымящая на воздухе жидкость, уд, вес 1)2о= 2,226; Г„ . 114,1°, *°ил. -30,2° или -33°. При действии влажного воздуха или небольших количеств воды на SnCli получается кристаллич. (монокли-нич. системы) масса состава SnCl4 ЗН2О, плавящаяся при 80°. При соединении 22 ч. SnCl4 с 7 ч. воды или при выпаривании раствора SnCli в соляной к-те, а также при насыщении водного раствора SnCl2 хлором и осторожном выпаривании полученной жидкости выделяются белые непрозрачн. остроконечные расплывающиеся на воздухе кристаллы состава SnCl4 5 Н2О. Этот гидрат SnCl4 плавится ок. 60° и очень легко растворяется в воде. Известны также гидраты SnCl4 с 4, 8 и 9 моле--кулами воды. Свежеприготовленный раствор SnCl4 очень плохо проводит электрич, ток, но с течением времени, благодаря гидролизу, его электропроводность возрастает. Гидролиз совершается по ур-ию: SnCli + 4НаО ;4НС1 -- Sn(0H)4, Оловянная к-та однако не выделяется в осадке, образуя коллоидный раствор. При нагревании процесс идет быстрее. Хлорное олово хорошо смешивается с CSa и служит растворителем для многих веществ, напр. в нем хорошо растворяются Р, S, J, As, SbJg и т. д. Известны многочисленные и разнообразные комплексные соединения и двойные соли SnCli, напр. известны вещества состава SnCl4-PCl4;SnCl4-POCl3;3SnCl4-PH3;SnOCl2- N2O5; 3SnCl4-2NOCl; 2SnCl4-SnS2; и т. д, Практич, значение имеет хлорооло-в я н н а я к-та, HaSnCle-eHgO, и нек-рые из ее солей. Хлорооловянная к-та получается при действии сухого хлористого водорода на смесь SnCl4 с соляной к-той уд, веса 1,166 (33%); реакция сопровождается сильным разогреванием. По ее окончании и после охлаждения хлорооловянная к-та кристаллизуется в виде бесцветных листочков, к-рые плавятся при Г ок, 20°, При стоянии на воздухе соль теряет НС1 и легко расплывается. Образование труднорастворимого кристаллич. осадка цезиевой соли хлорооловянной к-ты состава CsaSnClg при прибавлении SnClj к раствору CsClg, смешанному с равным объемом соляной к-ты, служит в микроанализе реакцией на соединения цезия. Н а т р и е-ваясоль хлорооловянной к-ты, NaaSnClg 5 Н2О, называемая кристаллич. хлорным оловом, получается при нагревании раствора 8пС1 с NaCl и применяется в крашении в качестве протравы. Наибольшее значение имеет (NH4)2SnCl6, розовая соль, пинкзальц, роза-пинкзальц, получаемая при действии избытка насыщенного раствора на- шатыря на конц. водный раствор SnCli. Она представляет собою белый кристаллич. порошок или октаэдрич. кристаллы уд. в. 2,387. При нагревании кристаллы растрескиваются и выделяют SnCli. В воде они растворяются в отношении 1:3. При кипячении конц. растворы не изменяются, а разбавленные разлагаются, причем все олово выделяется в виде оловянной к-ты. Пинкзальц применяют во многих случаях вместо хлорного олова, гл, образом в качестве протравы при крашении. Хлорное олово, по б. ч. в виде SnCl4-5H20, применяется гл. обр. в качестве аппретуры (для отяжеления шелковых тканей), а также протравы при ситцепечатании; в синтезе красителей-в качестве катализатора при хлорировании и окислительного конденсационного средства, В военном деле хлорное олово служит для образования маскирующих дымовых завес, а в смеси с некоторыми отравляющими веществами-для снаряжения химич. артиллерийских снарядов. При получении кассиева пурпура (см. выше при описании SnCU) хлорное олово применяется наряду с хлористым оловом. Метахлорное олово (SnCli) получается при кипячении /З-оловянной к-ты с соляной к-той. В конц. к-тах нерастворимо, но растворимо в воде. По количественному составу одинаково с обыкновенным хлорным оловом и отличается от него по своему свойству окрашивать растворы хлористого олова в желтый цвет. Такой же результат по.тучается при действии на растворы SnCla долго хранившихся растворов обыкновенного SUCI4, что заставляет считать, что метахлорное олово является полимером SnCli. Гидриды олова мало изучены. Они образуются в незначительных количествах при действии разбавленных к-т на олово или на сп.дав олова с магнием (Mgj-Sn), а также при действии 5%-ного раствора уксусной к-ты и 1 %-ного раствора щавелевой к-ты на старую жесть или на обыкновенное олово, приведенное в соприкосновение с металлич. железом. Достоверно известен только гидрид состава SnHj,-газ с tKun.~° 10°> горящий голубоватым пламенем и отличающийся большой ядовитостью. Его образованию приписывают отравления при употреблении в пищу консервированных продуктов, хранившихся в испорченных жестянках. Ф о с ф и д ы и а р с е н и д ы о л о в а. Описан ряд фосфидов олова, к-рые имеют значе- ние при приготовлении фосфористой бронзы. Из этих соединений наибольшее значение им>ет SHiPg, кристаллич. вещество серебристо-белого цвета, уд. в. 5,18 при 20°, начинающее разлагаться при 480°. Фосфид с ф-лой' SnP также представляет собою кристаллич. вещество металлич. вида; уд. в. 4,1.Его разложение начинается при 415°. Он легко подвергается действию дымящей HNO3. С мышьяком Sn образует гл. обр. соединение состава SnjA-Sg уд. в. 6,56 при 20°. Анапитичесное определение Sn в О.с.Перевод О.с. в растворимое состояние м. б. достигнут следующими способами: а) сплавление испытуемого вещества в никелевом или серебряном тигле с NaOH или КОН (получаются легко растворимые в слабых к-тах NaaSnOj илиKaSnOs); б) сплавление в фарфоровом тигле с серой и кальцинированной содон (Sn переходит в растворимую в воде сульфосоль NaaSiiSs); в) сплавление в фар-i форовом тигле с KCN(выделяется металлич. Sn, раство- Т. Э. т. XV. римое затем в соляной кислоте); г) восстановление до металлического олова в струе водорода при темно-красном калении. Качественные реакции. А. Общие реакции на Sn: а) Испытуемое вещество нагревают в восстановительном пламени на шарике фосфорной соли в присутствии следов меди; шарик окрашивается в рубиновокрасный цвет, б) Прокаливают исследуемое вещество на обугленной содовой палочке; получается ковкий королек Sn, покрывающийся при охлаждении белым налетом окиси Sn; королек не растворяется в HNO3 и растворим в концентр. НС1. в) К испытуемому раствору прибавляют в пробирке i/j см 5 %-ного раствора К J и после этого пипеткой по стенкам приливают 1/2 см конц. H2SO4: в месте соприкосновения раствора с HgSOi появляется яркожелтое кольцо, исчезающее при осторожном приливании концентр. НС1; присутствие Sb и As мешает этой реакции. Б. Реакции па Sn .a) При действии H2S-образование бурого осадка SnS, растворимого в многосерни-стои аммонии и в конц. кислотах, б) Под действием NaOH белый осадок Sn(0H)2, растворимый в избытке щелочи и кислотах, в) HgCla восстанавливается ионом Sn BHgCl (белый осадок, при избытке О.с. легко чернеющий), г) Образование черного осадка металлического Bi при действии испытуемого раствора на смесь растворов азотнокислого висдгута и NaOH. д) Образование темпокрасного коллоидного раствора золота (кассиева пурпура) при действии испытуемого раствора на AUCI3. е) Выделение металлич. Sn из солянокислых растворов при помощи металлич. Zn. ж) Образование синего осадкатурнбулевой сини Fe3[Fe(CN)e]a при действии на смесь FeCla и K3Fe(CN)6. з) Реакция Фейгля: появление синего окрашивания при действии капли испытуемого раствора на фильтровальную бумагу, пропитанную фосфорномолпбденовой кислотой и затем подвергнутую непродолжительному действию паров аммиака (чувствительность = 1:1 670 000), и) Синий 0,01%-ный раствор азокраски диазингрюн, при подкислении НС1 и переслаивании с раствором, содержащим соединения Sn , принимает через некоторое время разные оттенки от фиолетового до красного. В. Реакции четырехвалентного Sn. а) При действии HaS образование желтого осадка SnSa, растворимого в сернистом аммонии и в концентрированной НС1; б) образование под действием Na(3H белого осадка, растворимого в избьггке реактива и в к-тах; в) выделение металлич. Sn из соляно-кисдых растворов под действием Zn. Количественное определение Sn производится б. ч. путем титрования иодом. Соединения Sn восстанавливаются сперва в соли Sn . Соли Sn растворяют в соляной к-те,из сосуда вытесняют вог-дух углекислым газом, к раствору прибавляют винной к-ты и NaHCOa и титруют i/ioiV раствором иода. Кроме того соли Sn м. б. титруемы КМПО4. Для этого соль Sn или ее раствор прибавляют к кипящему кислому раствору Fe2(S04)3, после чего кипячение продолжают еще некоторое время (проба на KGNS должна после кипячения обнаружить присутствие избытка Fe *); затем раствор разбавляют и титруют раствором КМПО4. Е. Руппом предложен следующий мегод объемного определения Sn : раствор 1 г NaHCOs в 50 см воды медленно подкисляется 10-15%-Hoii HCl (5 см), после этого к жидкости прибавляют раствор соединения Sn , содержахций около 0,1 г Sn, кристаллик К JnpacTBop крахмала. После этого производится титрование UoN раствором хлорамина Т (7г-толуолсульфохлорамида натрия). Титр хлорамина устанавливается по NaaSaOs или по AS2O3. Колор и метрич, определение Sn по Гансену: к 10 см испытуемого раствора прибавляют несколько капель Вгз и 5 см свежеприготовленной сероводородной воды; Sniv образует осадок, полностью выделяющийся через несколько часов. Полученная смесь для определения общего количества Sn сравнивается со стандартными смесями, приготовляемыми действием H2S на растворы солей Snv определенной крепости. Другие 5 cjk3 испытуемого раствора обрабатывают 5 сиЗ сероводородной воды и по истечении нек-рого промежутка времени-5 аи* конц. Нг804. Происходит быстрое растворение SnS, а SnS2 остается в осадке и затем также определяется колориметрически. По разности двух этих определений судят о количестве Sn . Лит.: Менделеев Д., Основы химии, 9 изд., т. 2, М.-Л., 1928; М е н ш у т к и н Б., Курс общей (неорганической) химии, М., 1929; Смит А., Введение в неорганическую химию, вып. 2, пер. с англ., М.-Л., 1929; Г о л л е м а н А., Учебник неорганич. химии, пер. с н м., СПБ-Киев, 1912; О с т Г., Химич. технология, выи. 2, пер. с нем.. Л., 1930; Т р е д-в ел Ф., Курс аналитич. химии, 4 изд., т. 1, пер. о нем., М.-Л., 1927; РизенфельдЕ., Качественный анализ и неорганический практикум, пер. с нем., М.-Л-, 1930; Ф е д о т ь е. в П., Технич. анализ мине- ральных веществ, СПБ, 1906; Ворожцов Н., Основы синтеза красителей, М.-Л., 1925; Ш и к к О., Химик-текстильщик, пер. с нем.. П., 1922; Л ид о в А., Беление, крашение и ситцепечатание, химич. технология волокнистых веществ, СДБ, 1900; Р у гг л и П., Практикум по крашению и анализу красителей, пер. с нем., Л., 1929; ЖХП , 1930, т. 7, 6-6, 14-15; Ephraim F., Anorganische Chemie, 4 Aufl., Dresden-Lpz., 1929; Ullm. Enz., B. 12 u. a.; Handbuch d. anorganlschen Chemie, hrsg. v. R. Abegg u. F. Auerbach, B. 3, Abt. 2, Leipzig, 1909; V an In 0 L.,Handbuch der praparativen Chemie, 3 Aufl., B. 1, Stuttgart, 1925. B. Горшешиииов. ОЛОВО, Sn, элемент 4-й группы не рис-дич. системы, порядковый номер 50, ат. вес 118,7, ат. объем 16,3. Изотопы: 120,118,116, 124, 119, 117, 122, 121, 112, 114 и 115; 231, 85°, t°un. 2 275°; коэф-т сжимаемости при 20° 1,85-10~* см/кг; модуль упругости (0,4-f-0,55)-10* кг/см; врем, сопротивление на разрыв 1,7-2,5 кгмм; уд. теплоемкость (при 100°) 0,0564 cal; коэф. лин. расширения (18-100°)0,00002703; теплопроводность (при 18°) = 0,153 cal см/см ск. °С; электропроводность при 0°=7,66-10 * мо-сл ; температурный коэфициент сопротивления 465-105 магнитная восприимчивость = 8,025 10 в единицах CGSM. Существует несколько видоизменений О. а) Обыкновенное белое О.-ковкий металл серебристо-белого цвета, блестящий, кристаллич. строения (тетрагональной системы). Уд. вес 7,31 (при 20°),тв. (по Мосу) 1,8. При сгибании О.- издает особый треск ( крик О.), происходящий от разрыва кристаллов по плоскостям спайности. Легко раскатывается в очень тонкие (до 0,0025 мм) листочки - оловянную фольгу, или станиоль. Обладает также значительной способностью вытягиваться в проволоку (эта способность достигает наибо-ттьшего значения при t° 100-150°). Такая проволока однако очень непрочна и при диам. в 1 мм разрывается уже при нагрузке в 4 тег. Белое О. может быть получено медленным охлаждением расплавленного О. При понижении t° белое О. медленно превращается (при 1° ниже 18° оно находится уже в состоянии ме-тастабильного равновесия) в б) серое О., уд. вес 5,75. О. при этом увеличивается в объеме и распадается в порошок. Этот процесс, известный уже давно, носит название оловянной чумы . Соприкосновение обыкновенного О. с серым или с раствором какой-нибудь соли О., особенно с раствором двойной соли состава SnCl4-2NH4Cl (см. Олова соединения), способствует ускорению процесса. При t° выше 20° серое О. вновь превращается в белое, в) При нагревании обыкновенного О. выше 195° или при быстром охлаждении расплавленного О. образуется хрупкое О. ромбической системы. Три названные видоизменения олова представляют его энантиотроп-н ы е формы (сж. Полиморфизм), так как О. переходит из каждой из этих форм в другие в зависимости от температурных условий, г) Особым видоизменением О. до.лжна быть признана и его форма в виде тонких листоч ков (станиоль) или очень тонких пок]ювов на поверхности других металлов (слой О. на белой жести). Эта форма очень легко переходит в объжновенное олово (выше 19°) или в серое олово (ниже 19°). Нагревание способствует ускорению этого процесса. В соединениях О. бывает двувалентным и четырехвалентным. При обыкновенной Г О. не подвергается заметному действию воздуха и воды как в отдельности, так и при совместном их присутствии. При 100° О. окисляется кислородом воздуха очень медленно, при более высокой i° окисление идет быстрее. При сильном нагревании О., расплавившись, сгорает, образуя двуокись О., SnOj. Пары О. горят ярким белым пламенем. Раскаленное О. разлагает воду, выделяя из нее водород и образуя окись О., SnO. Сильные минеральные к-ты действуют на О. довольно энергично. Соляная к-та выделяет водород (а также невидимому незначительные количества SnH) и переводит О. в раствор в виде SnClg. Повышение концентрации к-ты и t° способствует сильному ускорению' реакции. При избытке НС1 и хорошем доступе кислорода воздуха SnClg переходит в SnCl4 по уравнению: SnCl2-l-2HCll+0 =SnCl4 + H20. Разведенная серная кислота слабо действует на О., также выделяя Н и образуя соль-двувапентного О. Конц. H2SO4 при кипячении реагирует по ур-ию: Sn + 2H2SO4 = SnS04 + SO2 + 2Н2О, причем выделяется также и нек-рое количество HgS. По отношению к олеуму на холоду О. очень устойчиво. При действии на О. значительно разбавленной HNO3 реакция идет по ур-ию: 48п-Ы0НКОз = 4 3п(КОз)2 + ЗН2О +NH4NO3. При этом образуется также гидроксиламин. Под действием HNO3 (уд. в. 1,25) происходит образование NO2, воды и нерастворимой метаоловянной к-ты повидимому в виде азотнокислого соединения /S-метаоловянной кислоты Н28пОз. В упрощенном виде реакция ы. б. изображена ур-ием: Sn + 4HN03 = H2Sn03 + 4N02+Н2О. В присутствии других металлов образующиеся под действием HNO3 соли этих металлов абсорбируются метаоловянной к-той,. причем простым промыванием их удалить не удается. Безводная HNO3 на О, не действует. Действие минеральных кислот на О. усиливается в присутствии свободного кислорода или других окислителей, а также при прибавлении небольших количеств солей металлов, к-рые вытесняются О. из их соединений (Си, Ag, Pt), или при соприкосновении с самими этими металлами. Присутствие сильных окислителей, напр. бихро-матов К и Na, ослаб-ияет действие к-т на О. т. к. при этом на поверхности О. образуется сплошной слой нерастворимых окислов, препятствующий его дальнейшему разъеданию. Слабые минеральные к-ты б. ч. не действуют на О. Относительно HCN существуют данные, свидетельствующие о том, что эта к-та не реагирует с истьш Sn, но разлагается при соприкосновении с продажными сортами О. С хлором О. легко вступает в реакцию.. Органич. к-ты действуют на О. слабо. Уксусная к-та с концентрацией ниже 60% на холоду не вступает с О. в реакцию. При кипячении на О. действуют растворы этой к-ты-с концентрацией выше 20%. О. не подвергается действию винной кислоты, влажных паров салициловой к-ты и т. д. Однако под влиянием кислого молока О. сильно разрушается при всех t°. Сильные п];елочи и некоторые соли оказьшаются б. или м. энергичными реагентами на О. При кипячении О. со щелочами выделяется кислород и образуются соли метаоловянной к-ты: Sn + 2 кон + НгО = К28п0з+2Н2. Растворы гидросульфита Na на О. практически не действуют. В ряду напряжения О. стоит между Ni и РЬ и т. о. вытесняется из его соединений большинством из важнейших металлов. С другой стороны, олово во многих случаях служит восстановителем благодаря легкому выделению им водорода из НС1 и образованию при этом SnCU. Соли О. бесцветны и неядовиты. В самородном состоянии О. встречается очень редко (в Сибири-в виде зерен вместе с золотом, в Гвиане и Мексике-в висмутовом шпате в виде маленьких листочков). Минералы, содержащие О., см. Оловянные руды. Расплавленное О. раств9ряет многие металлы и образует с большинством из них разнообразные сплавы с весьма ценными техническими свойствами. К числу таких сплавов относятся бронзы (см.) различных сортов, британский металл, мягкий припой, баббит, белый металл и другие. (См. Спр. ТЭ, т. II, Металлургия, стр. 172.) Металлургия О. В виду низкого содержания олова в его рудах и в виду того, что для металлургич. переработки материал должен иметь высокое содержание металла, все руды О. подвергают обогащению. Приемы, которые применяются при обогащении, сильно варьируют в зависимости от характера руды. Наибольшей простотой отличается обогащение руд аллювиальных месторождений и наибольшей сложностью-обогащение руд .коренных месторождений, а в особенности комплексных сульфидных руд. Обогащение руд аллювиального происхождения не требует никакого дробления; оно в существенных своих частях характеризуется двукратною обработкой на шлюзах и последующей отсадкой или на ручных блюдах или в Гарцевских отсадочных машинах (см. Обогагцение полезных ископаемых). В результате такого обогащения получают концентраты с содержанием 70,0-76,5% Sn. Более сложные схемы и более усовершенствованная аппаратура применяются при обогащении руд коренных месторождений. В процессе гидромеханич. обогащения таких руд приходится их всегда подвергать и промежуточным специальным обработкам, к-рые имеют своею целью наилучше подготовить руду для различных стадий грави-метрич. обогащения. Эти специальные обработки м. б. следуюпщх родов: 1) обжиг, сопровождаемый затем гидромеханич. обогащением, имеет целью наилучшее отделение одних минералов от других; .2) обжиг, сопровождаемый затем выщелачиванием обогащенного продукта водою или растворами кислот; 3) нагревание в присутствии натриевых солей с последующим выщелачиванием; 4) применение флотационного отделения сульфидов. Перед обжигом руда обыкновенно дробится до величины зерен в 6 мм; t° обжига ~ 550-650°. Расход горючего при этом варьирует от 5 до 15% от веса обжигаемой руды. В результате обжига руда претерпевает двоякие изменения; с одной стороны, она разрыхляется, нарушается связь между отдельными минералами, благодаря чему оловянный камень при последующем обогащении легче отделяется от сопутствующих ему минералов; с другой стороны, руда претерпевает и химич, изменения; сульфиды окисляются и дают сульфаты и окислы, большая часть серы и мышьяка и отчасти сурьмы удаляются. Последующее выщелачивание водою либо растворами к-т удаляет из руды растворимые в этих условиях соединения. Оловянные концентраты, содержащие вольфрам, нагреваются совместпо с NaaCOg или NaaSOi при 600°; при этом образуется вольфрамовонатриевая соль, растворяющаяся в воде, В случае содержания в руде значительных количеств сульфидов, руда подвергается хлорирующему обжигу с последующим выщелачиванием. Некоторые хлориды удаляются из руды уже в процессе обжига благодаря их летучести; так м. б. удалены хлориды висмута, свинца, мышьяка, сурьмы и серебра. Расход поваренной соли варьирует от 1 до 5% от веса руды. Плавка оловянных концентратов. В настоящее время единственным методом получения металлического О. из его руд является восстановительная плавка их. Восстановление окиси О. может быть осуществлено как твердьЕИ углеродом, так и газообразной окисью углерода. В обоих случаях реакция восстановления сопровождается большим поглощением тепла, как можно видеть из нижеприведенных термохимических данных: SnOa + C = Sn + C02 - 40 150 cal, Sn02 + 2CO = Sn + 2C 02 -1360 cal. Вследствие этого, а также благодаря необходимости получающийся при плавке шлак поддерживать в расплавленном состоянии, темп-ра печи достигает ~1300°. Такая высокая t° плавки, в особенности при рудах, содержапщх и другие кроме О. металлы, ведет к большему или меньшему восстановлению последних. Это влечет за собою загрязнение получаемого металлич. О. Особенно неблагоприятно влияют в этом отношении всегда почти присутствующие в руде окислы железа, которые в процессе восстановительной плавки дают металлич. лселе-30, сплавляющееся с О.; полученный сплав требует специальной переработки. Неблагоприятно на ход процесса выплавки О. влияет и амфотерный характер SnO 2, благодаря чему она легко шлакуется как кислотными, так я основными окислами, входяпщми в состав футеровки печей и шлакообразующих веществ. В виду этого очень часто шлаки оловянной плавки показьшают высокое содержание О., которое д. б. извлечено из них особой переработкой. Неблагоприятно влияет на ход выплавки О. и то обстоятельство, что в результате восстановления металлическое О, оказьшается очень сильно перегретым по сравнению с его f° . . (232°). Благодаря этому оно обладает очень значительной подвижностью и легко проникает через тонкие трепщнки пода печи; для ула- вливания вытекающего вследствие этого из печи О. приходится устраивать особые приспособления. Плавка оловянных руд. Рудную плавку для по./1учения сырого О. (О.-сырца), вед.уг обыкновенно в шахтных, но чаще в. пламенных печах. Шахтными печами пользуются в Китае, в Малайских Штатах, в Голландской Индии, в Боливии и в Саксонии. Пользование ими выгодно в тех случаях, когда руда достаточно чиста по своему составу или хорошо очищена и если возможно пользоваться древесным углем в качестве топлива. Шахтные печи для выплавки О. принадлежат б. ч. к типу шпур овьтх печей, т. е. печей с покатым дном, по которому расплавленный металл вместе со шлаками стекает в особое переднее гнездо, из которого затем О. выпускают в приемник. П1ахта этих печей сделана обьшновен-но из гранита и имеет небольшую высоту (до 3 м). К руде б. ч. добавляются шлаки прежних плавок. Темп-ра восстановления О. ок. 1100°. В результате плавки в шахтной печи получается О.-сырец и шлаки, а в случае значительного содержания железа в приемнике кроме того образуется большее или меньшее количество тугоплавкого сплава Sn с Fe-Hartling. В пламенных печах, применяемых в Англии, Германии, Австралии и на крупнейшем в мире з-де на одном из Малайских островов, выплавка ведется без дутья. Обожженный материал,содержащий обыкновенно 60% О., а лучше, если и более, тщательно смешивается с антрацитовой мелочью, служащей восстановителем. Расход ее обычно составляет 20-30% от прораба-тьшаемого материала. К этой смеси прибавляют и флюсы для получения желаемого шлака, отвечающего приблизительно следующему составу: 35% SiOg, ~15% FeO и 25% СаО. Шлак, содержащий ~11/г% Sn, считается чистьш и идет в отвал. Тщательно составленная и перемешанная шихта в количестве 12-15 т загружается в печь через 4 ста.льных воронки, расположенные центрально над печью. Загруженная в печь шихта разравнивается по поду, затем повышается жар. После того как шихта начинает оплавляться и приобретать тестообразную консистенцию, начинается перемешивание ее через каждые Va Плавка длится от 10 до 12 ч. Выпуск содержимого печи производится в передовой горн (см. Вангрес), где происходит отделение О. от шлака. О. из передового горна выпускается в чугунные горшки, а из них отливается в чушки. Сырое О. содержит обычно не менее 97% Sn, а в результате выплавки О. из руд Малайских Штатов и Голландской Индии получается О.-сырец с содержанием до 99,96% Sn. Примеси состоят гл. обр. нзРе,Си,РЬ, W, As. Выплавка О. в электропечах еще не получила широкого технич. применения. Однако ряд исследований свидетельствует об ошибочности общепринятого прежде мнения о невозможности использования этого способа для добывания О. из его руд. Плавка шлака. Гранулированный шлак рудной плавки смешивается с угольной мелочью и необходимым для образова- ния легкоплавкого шлака количеством и-з-вестняка. Количество угольной мелочи берется в 10-12% от веса шлака. Плавка ведется в пламенной печи и длится ~ 16--18 ч.; в результате получается отвальный шлак с содержанием обьгано 1V2% Sn, но не выше 2%, и сплав О. с железом. Рафинировка сырого О. Получаемое обычно в результате рудной плавки О. не является вполне чистым; оно содержит в себе ряд примесей, подлежаищх удалению процессом рафинирования. Рафинирование сырого О. производится двояким образом: пирометаллургическим и электрометаллургическим. Пирометаллургич. рафинирование, или зейгерование, состоит в том, что расплавленное О., t° которого д. б. только немного выше f°,jjj., вьгаерпьтают из содержащего его вместилища и заставляют стекать по покрытой глиной нак.донной чугунной плите размерами ок. 1,25x0,75 м. На плите раскладываются раскаленные древесные угли; олово стекает в чугунный тигель, а на плите остается тугоплавкий сплав О. с Fe, Pb, Си, W, As и т. д.-з е й г е р н ы е крецы. Такую обработку повторяют несколько раз до прекращения образования крецов. Зейгерование производится также в особых пламенных печах с несколькими отделениями, через которые постепенно проходит очищаемое О., все более и более освобождаясь от примесей. Последний способ в настоящее время считается наиболее пригодным. После зейгерования О. подвергают иногда последующему окислительному плавлению, наиболее употребительным способом к-рого являетсй в ы д р а з н ив а н и е. О. расплавляют в особом снабженном топкой чугунном сосуде, после чего в жидкий, сильно нагретый металл погружают шесты из сырого свежесрубленного дерева. При соприкосновении сырого дерева с расплавленным металлом выделяется большое количество водяных паров и газообразных продуктов разложения, что способствует энергичному перемешиванию металла и соприкосновению всех его частей с кислородом воздуха. Образующиеся при этом окислы примесей О. и самого О. собираются наверху в виде пенистой массы. В Англии с той же целью и с теми же результатами применяется способ, называемый tossing process и состоящий в непрестанном вьшерпывании и обратном выливании расплавленного О. особыми ложками. Олово, полученное путем рафинирования, содержит 99,6-99,9% Sn. В последнее время, в особенности при переработке комплексных оловянных руд, получаемое в результате рудной плавки металлич. О. предпочитают иногда рафинировать электрометаллургич. путем. Электролитом является раствор кремнефтористово-дородной K-Tbi(H2SiFe) с некоторым количеством H2SO4, необходимым для перевода свинца в нерастворимое соединение. Состав электролита приблизительно таков: 20,0% H2SiFe;0,l%>H.,SO4;6,0% SnO. Уд. вес равен 1,20. К электролиту прибавляется нек-рое количество клея, оказьшающего существенное влияние на качество катодного осадка. Иногда вместо кремнефтористоводородной кислоты применяют различные сульфоновые кислоты; состав такого электролита следую-пщй: 8,0% HaSO; 4,0% крезолфенолсуль-фоновой кислоты; 3,0% SnO; уд. вес 1,12. Электролиз производится в деревянных, выложенных внутри свинцом листами, электролизерах с внутренними размерами (в м): 3,33 X 1,04 X 1,065 (глубина); катодная плотность тока 110 А/л!; разность потенциалов на ванне 0,3-0,35 V.Использование тока равно 85%. Аноды содержат от 90 до 99% Sn. Переплавка катодов производится в 50-тонных чугунных котлах. Состав полученного электролитического О. таков: 0,0025% РЬ; 0,02%Си; 0,003%As; 0,004% Sb; 0,015% Bi; 99,94% Sn. г. Уразов и в. Горшешников. Добывание О. из обрезков белой жести, старых жестянок и т. п. Из этих источников ежегодно добывается не менее 10 ООО т О. Способами для этого могут служить: 1) обработка путем перевода О. в раствор хлорирующими жидкостями или щелочами (мокрый способ), 2) выплавка О. в различного рода печах (сухая металлургическая обработка), 3) электролиз в кислой или щелочной среде, 4) обработка сухим хлором. В настоящее время практич. значение имеют только электролиз в щелочной среде и обработка хлором. Электролиз белой жести в щелочной среде. Куски жести нагреваются с крепким раствором соды с целью освобождения от грязи, жира, красок, бумаги и т. д., промываются водой, штампуются в компактную массу, а затем погружаются в особых проволочных железных корзинах (причем в каждой корзине 50 кг обрезков) в раствор едкого натра и подвергаются электролизу. Куски жести служат анодом, а катодом - стенки железного сосуда для элек-тро-лиза и погружаемые в ванну железные листы. Электролиз ведется при Г 70° и при напряжении в 1,5 V. Концентрация раствора едкого натра не должна превышать 9% NaOH. Во время электролиза необходимо следить за тем,чтобы содержание углекислоты не превышало количества ее, с которым могло бы соединиться не более 2,8% NaOH, т. к. при большем содержании СОд происходит выпадение метаоловянной к-ты. Вследствие этого приходится часто регенерировать раствор электролита. Кроме того жестяные обрезки следует почаще разрыхлять при помощи железных вил. Сущность процесса заключается в переводе О. в раствор в виде NajSnOs и в последующем вытеснении его из этого соединения катионами Na. О. выделяется на катодах в виде губчатой массы и содержит 2-3% свинца, от к-рого его в дальнейшем отделяют путем восстановления углем или переводом путем обработки к-тами в соли. Описанный способ применяется в Германии, Англии, Голландии и Америке. В последних двух странах в настоящее время экономически наиболее целесообразной считается обработкабе-лой жести сухим хлором. Способ основан на том, что О. легко подвергается химич. действию сухого хлора, между тем как на Fe хлор действует только в присутствии влаги. Так. обр. для успешности применения этого способа необходимо полное отсутствие влаги. Подготовленные, как было сказано выше, жестяные обрезки спрессовывают в пакеты по 50-60 кг, помещают в большие цилиндры из кованого железа и подвергают действию безводного жидкого хлора, пропускаемого под давлением в - 2 аШ. При этом вследствие выделения значительного количества тепла (127 250 cal на з-мол. образующегося SnCli) цилиндры необходимо охлаждать. щи, В продажу О. поступает в виде болванок, тонких длинных прутьев или же в виде свернутых листов. Количество ежегодно добываемого О, достигает 150 ООО т. Для получения из продажных сортов совершенно чистого О. применяются различные способы. Наиболее употребительны следующие. 1) Обработка оловянных опилок HNO3 с последующим извлечением образовавшегося окисла соляной кислотой и водой и восстановлением при помощи прокаливания с сахарным углем при слабо белом калении. 2) Расплавленное продажное О. с о-ва Банки гранулируют, выливая его в воду, и затем обрабатывают его на холоду, не доводя однако до полного растворения. В раствор переходит олово со следами Zn; его доводят до кипения, осаждают раствором соды и осадок обрабатывают HNO3 Для переведения О. в нерастворимую метаоловянную кислоту, которую затем прокаливают с сахарньш углем или сплавляют с цианистым калием. 3) Вытесняют О. из его соединений в солянокислых растворах действием цинка. Порошкообразное О. (Stannum га-spatum) получают, измельчая хрупкое О., приготовляемое путем медленного ох.т1ажде-ния (до 200°) расплавленного чистого О. Губчатое О.-аргегшип(см.)получают в виде светлосерого, очень устойчивого по отношению к внешним воздействиям порошка, путем вытеснения О. кусками цинковой жести из водного раствора SnClg, обработан, ного смесью растворов NaOH и KCN, и промывания псчученного губчатого О. водой. Применение О. Вследствие устойчивости О. по отношению к действию воздуха, воды, слабых кислот и неядовитости его солей оно широко применялось для изготовления различных предметов домашнего обихода (посуды, игрушек и т. п.). В промышленности О. имеет разнообразное применение. В химич. промышленности диетами из О. выкладывают внутренние стенки различных сосудов; его применяют при производстве кристаллич. винной к-ты и различных солей; аргентин применяется для крашения тканей. В машиностроительной промьппден-ности О. является важнейшей прибавкой для образования подшипниковых сплавов и бронзы (см.). Наибольшая масса О. идет на приготовление белой жести (см.) и для лужения медных и железных предметов. Speculum-металл для зеркал, в среднем содержит 33% О. и 67% меди. Тонкие листочки О. (станиоль) применяются для обертывания шоколада, чая и других предметов; при изготовлении фольги (и трубок для тюбиков) вредно влияет примесь (в сотых долях %) алюминия. О. применяется также при изготовлении различных припоев. В виду сравнительно редкого нахождения О. в природе его начинают заменять в промышленности др. металлами; напр. в подшипниковых сплавах-свинцом, в бронзах- фосфором и алюминием, в жести-цинком. Для определения чистоты О. его испытывают на присутствие РЪ, Си, Fe и Zn. Для этого 5 0 олова обрабатьшают 40 cjn HNO3 на водяной бане до полного превращения его в белый порошок, выпаривают досуха, к остатку прибавляют 10 см HNO3 уд. веса 1,153 и 50 см воды и фильтруют. Фильтрат обрабатывают 1 см разбавленной H2SO4 и как можно полнее выпаривают на водяной бане; остаток обрабатывают 10 см воды. Отсутствие весомого твердого остатка докажет, что примеси РЬ не имеется. Жидкость, если нужно, фильтруют и фильтрат обрабатывают раствором аммиака до щелочной реакции. В отсутствии Си жидкость не должна принимать го.дубого оттенка. Далее жидкость обрабатывают сернистьпи аммонием и оставляют стоять 4-5 ч. при t° ок.. 50°. В случае образования осадка он не должен после прокаливания весить больше 0,002 г (проба на Fe и Zn). Лит.: о с т г., Химич. технология, пер. с нем., 2 изд., вып. 2, стр. 103-107, Л., 1930; Товароведение, под ред. П. Петрова и Ф. Церевитинова, 8 изд., т. 1, М.-Д., 1927; Смит А., Введение в неорганическую химию,пер.с англ., вып. 2, стр. 355-357, М.-Л., 1929; Голлеман А., Учебник неорганической химии, СПБ-Киев, 1912; Менделеев Д., Основы химии, 9 изд., т. 2, стр. 106-108, 343-344, М.-Л., 1928;Меншуткин Б., Курс общей (неорганической) химии, стр. 317-321, М., 1929; М е й с т е р А.К., Олово, Встеств.производит.силы СССР , 2 изд., П., 1922, т. 4, вып. 12; Су щи некий П., Очерк месторождения вольфрамовых и оловянных руд в России, Материалы для изучения естеств.производит, сил России , П., 1916, вып. 5; Т е т я е в М. М., Вольфрамовые и оловянные месторождения Онон-Борзинского района Забайкальской области, Матер, по общей и прикладной геологии , П., 1918, вып. 32; Ф е д о т ь е в П. П., Технич. анализ минеральных веществ, стр. 139-147, СПБ, 1906; Химико-технический справочник, ч. 1, Ископаемое сырье, 2 изд., ч. 1, вып. 2. П., 1923; Артемьев Б. Н. и Берлинг Н. И., Олово, Годовой обзор минер, ресурсов СССР за 1926/27г. ,Л.,1928; Применение металлического олова сусальное) состоит из сернистого олова SnS а и образует чешуйки золотисто-желтого цвета, постоянные на воздухе; оно получается мокрым или сухим путем. По первому способу обрабатывают конц. раствор хлорного олова SnClj избытком сероводорода. По второму способу смешивают порошок серы с измельченной стружкой олова и нагревают. Реакцию ведут весьма осторожно: к смеси добавляют нашатырь и по началу его разложения определяют предел нагрева смеси: слишком высокая t° изменяет тон и блеск сусального золота. Нагревание ведут в железных сосудах с крышкой в виде шлема, с отводными трубками для паров серы и аммиака. Примерный состав смеси: оловянных опилок 40 ч., серы 35 ч. и нашатыря 25 ч.; вещества тщательно смешивают и медленно нагревают до темнокрасно1о каления. Другой способ: предварительно приготовляют амальгаму из 2 ч. олова и 1 ч. ртути; 18 ч. этой амальгамы смешивают с 7 ч. серы и с 6 ч. нашатыря и подвергают нагреванию. Мусивное, или сусальное, сере-б р о-амальгама, получаемая сплавлением в фарфоровом сосуде 1 ч. ртути с 4 ч. опилок олова. Застьшшую массу амальгамы превращают в порошок на мельницах с прибавкой висмута. При производстве сусального серебра необходимо иметь в виду, что слишком тонкое измельчение уменьшает его блеск. Зелень Гептеле приготовляется из раствора 59 ч. хлористого олова и 125 ч. медного купороса осаждением едкой щелочью; осадок прокаливают. O.K. применяются в масляной живописи, в обойном деле и для окраски гипсовых изделий, а также как акварельные краски. П у р п у р н О е 3 О л о т о, или кассиев пурпур, см. Олова соединения, с. Михайлов. Лит.: см. Краски митральные и Малярное дело. ОЛОВЯННЫЕ РУДЫ. Из оловосодержащих минералов, приведенных в табл. 1, Табл. 1,-о .тг о в о с о д с р ж а щ и е минералы.
В химич. промышленности, ЖХП , 1930, т. 7, 5-6, стр. 396-397; Ullm. Enz., В. 12; Handb. d. anorg. Chemie, hrsg. v. R. Abegg u. Fr. Auerbach, B. 3, Abt. 2, Lpz., 1909; V a n i n 0 L., Handb. d. praparativen Chemie, 3 Auflage, B. 1, Stuttgart, 1925; Ephraim F., Anorganische Chemie, 4 Aufl., Dresden-Leipzig, 1929; Borchers W., Huttenwesen, 2 Auflage, Halle a/S., 1911; Neumann В., Elektrometallurgle des Eisens, Monographie iiber angewandte Elektro-chemle, B. 26, Halle a/S., 1907; Mennicke H., Die Metallurgie d. Zinns mit spezieller Beriicksichti-gung d. Elektrometallurgle, ibid., B. 39, Halle a/S., 1910. B. Горшешников. ОЛОВЯННЫЕ КРАСКИ. К числу O.K. относятся: сусальное, или мусивное, золото и серебро, оловянная фиолетовая и зелень Ген-теле. Сусальное золото (см. Золото только оловянный камень и отчасти оловянный колчедан имеют промышленноезна-чение в качестве руды на олово. Примесями в оловянном камне служат TagOj и Ге20з. Цвет его обычно Темный или коричневый от примесей. В чистых разностях бесцветен. Зернистые и плотные массы с алма-зовидным блеском. Часто встречается в прекрасных кристаллах, друзах и двойниках тетрагональной системы. Хрупок. Излом неровный. Генетически оловянный камень связан с кислыми гранитными породами и обыкновенно сосредоточивается в верхних частях гранитных массивов. Жилы оловян- ОЛОВЯННЫЕ РУДЫ ного камня образовались вследствие влияния пневматолитич. процессов при участии фтористых соединений. На это у1сазывает парагенезис его с флюоритом, литиевой слюдой, топазом и турмалином. Боковые породы оловяннокаменных жил обычно значительно видоизменены и превращены в т. наз. г р е й 3 е н. Реакцию образования оловянного камня можно представить в след. виде: SnF4 + 2H20 = Sn02 + 4HF. Оловянный камень также выделяется из горячих водных растворов вместе с кварцем. В зоне разрушения SnOj не изменяется и скопляется при разрушении пород в виде россыпей. Оловянный колчедан, или ( т а н н и н, имеет цвет-от серо-черного до бронзово- и бледножелтого. Обьганой примесью станнина является цинк. Встречается станнин в форме плотных и зернистых масс, чаще в виде мелких вкраплений в рудоносных жилах вместе с пиритом, сфалеритом и другими сульфидами. Цилиндр и т имеет блеск металлический, цвет свинцово-серый; он напоминает по своему внешнему виду графит. Встречается в виде цилиндрических, листоватых и пластинчатых агрегатов. Франкеит наиболее обычными примесями имеет серебро, цинк, железо и германий. Встречается в плотных, радиально лучистых, а также столбчатых и шестоватых агрегатах. Сильно напоминает цилиндрит. Канфильдит встречается как редкость (в месторождении Coiquechaca в Боливии). Блеск алмазовидный металлический. Цвет черный с красноватым или синеватым тонами. Самородное олово почти неизвестно. Имеются лишь небольшие образцы, хранящиеся в разных музеях. В нек-рых полиме-таллич. месторождениях отмечено присутствие олова, напр. в цинковой обманке (Фрей-берг, Корнуол), в пирите (Боливия) и др. Главной и почти исключительной рудой на олово служит оловянный камень. Большинство месторождений дает о.товянный камень, отличающийся низким содержанием олова. Руду необходимо предварительно обогащать, получая концентрат, к-рый и идет в плавку. О мировой добыче О. р. можно судить по количеству олова, содержащегося в этих рудах (табл. 2). Месторождения О. р. В СССР наиболее важными в промышленном отношении являются месторождения вост. Забайкалья. Площадь, занимаемая этими олово-рудными месторождениями, ограничена р. Шил-койи Борщевочным хребтом (с С. и С.-З.), средн. и нижним течением.pp. Онона и Онон-Борзи (с 3. и Ю.-З.) и рекой Аргу-нью(Ю.-В. и В.). Наиболее значите л ьньпии мес- орождениями этой груп- пы являются следующие: Ононское (на лев. берегу Онона, в 3 кл к С. от ст. Оловянная) ; Шерловая гора (Бурято-Монгольская АССР, Ачинский аймак); Завитинское (Вост.-Сибирский край, при слиянии pp. Ингоды и Онона); Мало-Кулдинское (в 6 к С.-В. от Ононского месторождения); Мало-Хапче-рангинское месторождение (в пограничной части юго-восточного Забайкалья с Монголией) и другие. Из всех этих месторождений наиболее обнадеживающими в промышленном отношении являются Хапчерангинское и Шерловогорское. В зап. Забайкальи пока известны лишь немногочисленные месторождения касситерита по р. Хосуртаю, по р. Хилкочену в 45 км к востоку от Улан-Батора. В Д.-В. крае наибольшего внимания заслуживают месторождения: в районе Хар-гинского золоторудного месторождения (по верховьям р. Харги, посклону горы Чайной) установлен оловянный камень; на западном склоне хребта Сихота-Алин, попади Безымянной; на вост. склоне хребта Сихота-Алин, в окрестностях горы Судно; по реке Тукуньку, в южн. части Сахалина; на мысе Чаплина (Чукотский нос). В Сибири (ср. и западной) установлено несколько пунктов с признаками оловянного камня: месторождение Кара-Куим между pp. Аманата и Таргыном; Базун-Бай (в 11 км к С.-В. от Кара-Куим); Минчинкур-по реке Тагою; Крук-Чурук в верховьях р. Тайништы, в 20 KJH к Ю. от Кара-Куим, и по р. Урунхаю, правому притоку р. Облайки. Все эти месторождения расположены в пограничной зоне с Казакстаном в районе Калбинского хребта (на левом берегу Иртыша, к Ю.-З. от Усть-каменогорска). По нижнему течению р. Ангары (pp. Татарка и Верх-Мурожная, по склонам Татарского хребта в Енисейской тайге) установлено значительное количество иногда довольно крупных зерен, даже галек касситерита. Есть указание на налиТ а б л. 2.-Мировая добыча олова (в т). 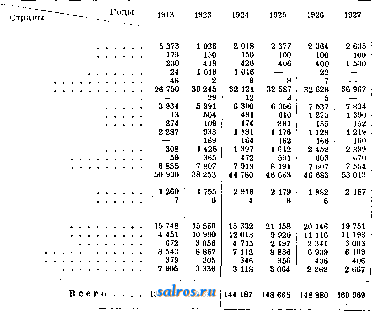 Великобритания Германия Испания И Португалия Чехо-Словакпя США Боливия Прочие страны Америки Нигерия Бельгийское Конго Свазиленд Южно-Африканский Союз Прочие страны Африки . Британская Индия Индо-Китай Сиам Федерат. Малайские Штаты . Нефедеративные Малайские Штаты Стретс Сеттлемент Голландская Ост-Индия: Банка Биллитон Прочие о-ва Китай Япония Австралия чие О. р. в Горно-Бадахшанской автономной области, на правом берегу Пянджа выше устья р. Ранча (у кишлака Бараун). На Урале отмечается наличие касситерита на Мурзинке (вост. склон Урала), в россыпях Миасских золотых приисков. На севере СССР, в районе Пазь-реки на Мурмане находят О. р. вместе с магнитным железняком. Из оловорудных месторождений других стран наиболее важными являются следую-п1;ие: 1) в 3. Европе-Корнуол, Девоншайр (Англия), Рудные горы (Саксония), отчасти Португалия и Испания; 2) в Азии-Малайский полу о-в, Нидерландская Ост-Индия, Бирма, Сиам, Индо-Китай и Китай, Япония; 3) в.Ю. Америке-Боливия (Кордильеры); 4) Африка-Нигерия, Бельгийское Конго, Трансвааль, Наталь; 5) Австралия- гл. обр. Новый Южный Уэльс и Тасмания. Ввоз олова в СССР см. табл. 3. Табл. 3.-Ввоз олова в СССР (в гп).  В плитах, свинках, прутьях, cTpyiKKax, \ ломе.........j 6 035 1 2 524 В листах......! 32 1 О 2 029 ( 2 234 \ 2 748 50 11 О Лит.: Артемьев Б. Н., Олово, М.-Л., 1930; его же, Горно-экономич-. характеристика Онон-ского месторождения и дальнейшие задачи его изучения, ГЖ , 1928, 11, 12; Берлинг Н. И., Проблема олова в СССР на фоне мирового состояния оловянной промьпплепности, Труды 1 Всес. совещания по цвети, металлам , М., 1925; Олово, Годовой обзор минер, ресурсов СССР за 1925/26 г., Л., 1927 и за след. годы; Джаксон M.H., Мировая оловянная промышленность в 1927 г., Металл , М., 1928, -; Зиновьев П., К вопросу об олове на Урале, Уральский техник , Свердловск, 1914,6; Маслениц к и й И., Метод оценки руды как сырья для рентабельного получения металла, Поверхность и недра , М., 1927, т. 5, 3 {39); М е й с т е р А.,Олово, сборн. Естеств. произв. силы РСФСР , 2 изд.. П., 1922, т. 4, вып. 12; Обручев В. А., К вопросу о поисках оловянных руд в Енисейском крае и о Тунгуе-ско-Монголо-Охотском металлич. поясе, Поверхность и недра , Москва, 1927, т. 5, 7-8; Преображенский И. А., Месторождения цветных металлов хребта Сихота-Алин, Труды 2 Всес. совещания по цветным металлам , Москва-Ленинград, 1927, т. 1, вып. 2; Смирнов С. С, Свинцовое месторождение по Б. Хапчеранге и вновь открытое оловянное месторождение по М. Хапчеранге (южное Забайкалье), Вести, геологич, комитета . Л., 1928, т. 3, 5; Мелузов н.. Процесс хлорирования, МС , 1928, 2, стр. 158-160; Ф е д о р О в с к и й Н. М., Минералы в промышленности и сел.хозяйстве,2 изд., Л., 1927; его же. Минеральные богатства Юж. Африки, МС . 1929,11/19; А h 1 f е 1 d F., Beitrage zur Kennl-nis sekundiirer Metallverschiebungen aul bolivianischen Zinnlagerstatten, eZtschr. f. prakt. Geol. , Halle a/S., 1927, fl. 6; В lenkinsop G. H., Transwaal Tin Deposits, MiningMagazine*, L., 1913,v. 10,May; Boydell H. C, Tbe Solubility of Cassiterite, Bulletin of the Inst, of Mining a. Metallurgie , London, 1927, 275, 277, 278; Brown G. E., Visiting the Hunan Tin-fields, Mining Magazine , L., 1915, v. 13; D a v 1 e s G. M., Tin Ores, Monographs on Mineral Resources with Special Reference to the British Empire, London, 1919; Purness J. W., Consumption of Tin in the United States, 1925, Minlng Journal*, London, 1927, V. 157, 4780; J 0 n e s W, R., Tlnflelds of the World, L., 1925; К 0 e b e r 1 i n F. R., Geology Features of Bolivias Tin-bearing Veins, Engineering a. Mining Journ. Press , N. Y., 1926, v. 121, 26; К u d i e 1 к a E., Die Zlnn- u. Wolframbergbaue von Schonfeld und Schlaggenwald in Bohmen, Montanistische Rundschau , W., 1919, B. 2; M und ay A. H., Tin a. the Tin Industry, The Metal History, Character a. Application, L., 1928; S с r 1 V e n 0 r J. В., The Geology of Malayan Ore-deposits, London, 1928; Vivian A. C, Flotation of Tin Ores, Mining Magazine*, L., 1927, T. 36, 6. H. Федоровский. ОЛЬФАКТОМЕТРИЯ,способ измерения остроты обоняния, к-рый неразрьшно связан как по методам, так и по теории с о д о р им е т р и е й^-способом определения силы запаха пахучих веществ. Оба метода до последнего времени служили для разрешения проблем связанных с. физиологией обоняния, но постепенно завоевывают практическое значение при изучении пахучих веществ и их промышленном использовании в парфюмерном производстве. Тем не менее и ДО сих пор применение ольфактометрии возможно лишь с учетом ряда ограничительных условий, связанных с физиологией и психологией обонятельных впечатлений. Для ольфактометрических измерений непременным условием является экспериментирование с одним и тем же пахучим препаратом. Для одориметрических измерений настолько же обязательным признается выполнение измерений одним и тем же экспериментатором, т. к. приходится учитьшать индивидуальную восприимчивость как общую, так и специфичную к определенным пахучим веществам. По этим же причинам получаются недостаточно показательные результаты при определении силы запаха веществ, характер запаха которых различен, например ионона и мускуса. Теоретически обоснованием обоих методов является определение границы восприятия или предела разбавления-minimum praecipitabile. Эта величина может иметь неспецифичное значение в том случае, когда определяется граница восприятия обонятельного впечатления вообще, определение же характера запаха при этом остается невозможным. Специфическая граница восприятия относится к тому случаю, когда при предельном разбавлении имеется возможность распознать данное пахучее вещество. Наибольшее практич. значение должен был бы иметь второй еду-чай, но он наименее разработан. В зависимости от применяемой методики результаты ольфактометрич. и одориметрич. измерений выракаются в абсолютных или относительных единицах. Методы первого порядка обычно пользуются указанием весового количества (ж) пахучего вещества в 1 cjtt воздуха, к-рое вычисляется по следующей формуле: где р-упругость пара вещества, Р-барометр ич. давление, v-объем воздуха, насыщенного парами вещества, V-обищй объем воздуха с парами вещества после разбавления, S-уд. вес паров пахучего вещества, равный М/22,4-1000, гдеМ-его мол. вес. Величина ж носит название о л ь ф а к т ы данного вещества и, будучи помножена на с л/ ч> 1л21 --, дает число молекул в одном см. Сравнительно реже применяется выражение в % насыщения по отношению к воздуху. Для выражения силы запаха предложено пользоваться величиной, обратной ольфакте. Наиболее совершенным прибором для определения этих величин является прибор Ф. З^офмана и А. Кольрауша (фиг. 1). Он 1 2 3 4 5 ... 49 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© 2007 SALROS.RU
ПромСтройМат |