 |
 |
 |
 |
1 ... 26 27 28 29 30 31 32 ... 48 жа, скобленая, курчавая нряжа, масляные и грязные концы, неправильные узлы. Из браковочной, пряжа поступает в красильный или белильный отдел. В красильном ч1тделе мотки надеваются на особые мотовила, на которых они растягиваются деревянными палками. Мотовило с мотками иряжи поднимается подъемным краном и онускает-<.:я в красильную ванну-барку, наполненную горячей водой с раствором красителя. Для более полной и равномерной окраски мотовило,иогрулсенноев красильную барку, медленно вращается. После окраски мотовило нодни.мается подъемным краном и после того, как с него стечет немного краска, оно опускается в промывную барку, а после промывки ставится на свое прежнее дтесто; пряжу с него снимают и в телелжах подают к центрифуге, иа к-рой отжимают; после отжима пряжа идет в суипглку, откуда высу-П1еиная поступает в перемотку. Если пряжа назначается в отбелку, то она в мотках iсначала поступает в особое помещение, где \ютки связывают в непрерывную цепь; эта цепь перекидывается через вращающийся барабанчик, находящийся над бучильным котлом, и загружается в котел; после бучения пряжа поступает в особые баки для хлорирования, затем в другой бак для кисловки и затем уже в промывную машину для промывки. После промывки пряжа по-сгупает в подсинильную машину для лод-;иньки. Затем пряжа подвергается отжимке на центрифуге, а после отя-сима идет в сушилку, откуда высушенная поступает в перемотку. На перемоточных машинах мотки пкраитг'нной или отбеленной ирялси ппу)о- 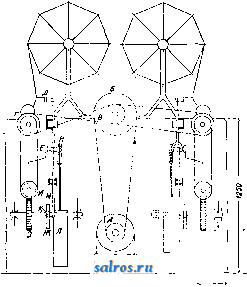 1750 Фиг. о. матывают па фланцевые катушки, чтобь! < них затем ггрялсу пере-ютать на маленькие швейные катушки. Мотки надеваются нат.н. рогульку, которая состоит из втулки с двумя рядами спиц, по 8 сгпщ в каждом ряду; спицы по концам соединены шнурком. Нитка с мотка проходит через крючок во- дилки перемоточной машины .(фиг. 5) и поступает на катушку, которая опирается на барабан. Сидящий на моторе шкив А передает двилсение ремнем шкиву Б, на одной оси с которым сидит шкив В, последний ремнем передает движение шкпву Г, который сидит на барабанном валу и т. о. вращает все барабаны. Фланцевые катушки вращаются благодаря трению, так как они .лежат на вращающихся барабанах. Для равномерного мотания нитки вдоль катушки в.лево и вправо двилутся водильные п.лаыки Д п Е с крюч-калпг. Водильная планка получает движение от эксцентрика Ж, к-рый закреплен на  Фиг. 6. одной оси с червячным колесом 3; последнее сцеп.ляется с червяком И, ось которого получает движение посредством ремня от барабанного вала. К эксцентрику Ж прижимается каточек К силой тял-сести гири Л. Каточек К связан с рычагами М и Н, сое-диненны-ми с водильными планками Д и Е. На новых машинах имеются два ряда i)o-гулек (вверху и внизу); один барабан приводит во вращение две катушки; одна иа них прилегает к барабану сверху, а другая-снизу. Нитки при обрыве связываются узлом ири помощи узловязателя. Скорость барабанов ~350 об/м ; при этой скорости линейная скорость мотания ~ 130 м в мин. Если нитки д. б. глянцевыми, то прежде чем наматываться на швейные катушки, они поступают с перемоточных маппш на полировочные машины. .Здесь нитки шлихтуют, т. е. пропитывают к.леем для придания им крепости, мягкости д б.леска, а затем просушивают и по.лируют, подвергая действии- щетинных щеток. По.лировочные машины устраиваются или с подогревом для сушки или без подогрева; в машине без подогрева нитки после пропитывания клеем иооходят более д.линный путь, для того чтобы успеть просохнуть. На фиг. 6 изображена схема пслировочиой машины с подогревом. Нитки, намотанные на ф.ланцевые катушки и помещенные в рамки А, проходят через глазки Б в корыто с горячим к.леем В; в корыте по-:мещаются два отлшмпых крахма.льных валика Г, причем нижний валик до половины погружен в к.лей. Далее нитки идут через направляющие валики: через гладкий медный валик Д, бэро.здчатый медный ва.ликК и через гладкие валпки Ж и 3 и далее поступают на фланцевые катушки, помешенные в рамке И. Щеточный вал К, вращаясь со скоростью около 350 об/м., полирует нитки. Нитки просушиваются нагретым всздухом. т. к. иод щеточным барабаном распололсены трубы с горячим паром. Фланцевые катушки в рамке И сидят на веретенах, которые приводятся в движение посредством шнурков от жестяных барабанов. В состав клея для черных ниток входят обычно картофельная мука, воск и касторовое масло; для белых ниток-только картофельная мука и касторовое масло. Картофельная мука может быть заменена другими крахмалами. Следуюший процесс работы после перемоточных машин для матовых ниток и после полировочных машин для глянцевых ниток-это намотка ниток на швейные катушки, к-рая производится на специальных машинах. Намоточные машины подразделяются на автоматы и полуавтоматы. На полуавтоматах съем и заправка новых катушек производятся вручную, а автоматически выполняется только намотка; на автоматах вся работа производится автоматически: намотка, съем готовых и заправка пустых катушек совершаются без участия человеческих рук; работнице остается лишь обрезка концов нити, просмотр намотанных катушек, связывание узлов при обрывах нити и уход за машиной (смазка и чистка). В настояшее время имеют широкое применение две конструкции автоматов: Вильдс и Мак-Ги . В намоточной машине Вильдс фланцевые катушки ставятся на рамку машины; нитка идет с катушки вверх и проходит между тарелочными зажимами с прунинками, к-рые придают нитке известное натяжение; затем нитка для получения гладкости проходит через парафиновое кольцо, огибает фарфоровый ролик, проходит через крючок и попадает на особую деталь, так наз. правку , к-рая и дает точное направление нитке при наматывании на швейную катушку; швейная катушка получает в{защение от вращаю-шегося шпинделя, так как она зажимается между двумя шпинделями, один из которых передает катушке движение, а другой свободно врашается. На фиг. 7 изображена швейная катушка; легко видеть, что при наматывании на нее нитка должна направляться правкой т. о., чтобы длина намотки постепенно увеличивалась от величины а до величины Ъ, а высота намотки постепенно увеличивалась соответственно увеличению диаметра катушки от d до D. Увеличение длины намотки достигается тем, что движение правки связано с движением особой детали- молоточка ; молоточек движется то влево то вправо, прижимаясь пружинками то сверху то снизу к стальной пластинке, имеюшей форму трапеции и называемой стрелкой . На фиг. 8 показаны стрелка А и молоточек В. Т. к. во в})емя работы стрелка все подвигается вперед, то путь мо.лоточка все время увеличивается, начиная от величины а и кончая величиной Ь, благодаря чему и путь правки соответственно увеличивается от о до Ь. Вместе с переходом молоточка с верха стрелки на ее низ, а также с переходом с низа стрелки на ее верх происходит включение той или другой плашки (левой или нравой), к-рые находятся против особого т. н. винтового валика; на этом валике имеются две резьбы: одна-левой руки, а другая-правой; к ним Фиг. 7. К- ь  попеременно прижимаются то одна то другая плашка, отчего и правка получает движение попеременно то влево то вправо. Скорость вращения винтового валика мо :ет изменяться при заправке ниток другого номера, так как на оси его имеется сменное намоточное колесо. Если число зубьев намоточных колес обозначим через z и z-, а номера ниток через и JVj, то между ними существует следующая зависимость: т. е. числа зубьев намоточных колес пропорциональны корням квадратным из номеров. Высота правки при наматывании изменяется благодаря тому, что особая кулачная шайба при работе катушки поворачивается и через ряд рычагов поднимает правку все выше и выше. Для регулирования скорости подъема правки д.ля разных номеров ниток на одном из рычагов имеются деления; вдоль этого конца рычага может передвигаться и закрепляться муфточка с каточком, к-рый и передает движение следу- g ющему рыча1у; т. о. является возможность изменять плечо рычага и тем самым изменять скорость подъема правки. При заправке нового номера ниток на ав-томате Вильдс следует переменить: 1)швей-ные катушки соответственно номеру hiitok; 2) стрелку соответственно катушке; 3) сменное колесо на винтовом валике; 4) сменное храповое рядовое колесо, от числа зубьев к-рого зависит число рядов намотки;5)правку соответственно номеру ниток; 6) подъем правки путем передвижения втулки с роликом на линейке с делениями. Авто .маты Мак-Ги по своей конструкции несколько отличаются от автоматов Вильдс : молоточек здесь ходит не по стрелке, а внутри вырезов особых пластинок, двигающихся взад и вперед до известных пределов. Полуавтоматы имеют менее сложную конструкцию. На них обычно перематывают брак, а также наматываются катушки с больпюй длиной нитки (до 2 400 ярдов) или же наматываются очень толстые нитки. Измерение длины намотанных на катушки ниток производится в ярдах (1 ярд= 0,914 м). Обычно нитки в 6 сложений наматываются на катупжу с длиной в 200 ярдов; нитки в 3 и 4 сложения наматываются длиной в 200, 500, 1 ООО и 2 400 ярдов: нитки в 9 сложений наматываются в 200 и в 400 ярдов. После намотки на швейные катушки нитки поступают в сортировку или браковку. Сортировщицы на наклони, столах просматривают все катушки с нитками и откладывают брак для перемотки. Просмотренные катупиш из сортировки поступают на этикетные маишны. Эти кеты нак.леиваются на торцы катушек автоматически. С наклонного листа катушки попадают на транспортер, к-рым подводятся к ударнику. На ударнике имеется 8 пальцев или сосков, в которых посредством насоса создается вакуум; сосок притягивает к себе этикетку, на которой с одной стороны уже имеется клей, и смачивает сторону с клеем о мокрое сукно; когда же сосок ударяет в то- рец катушки, воздух в соске соединяется с наружным воздухом, вакуум пропадает, и этикетка, легко отходя от соска, приклеивается к катушке. После наклейки катушки отводятся транспортером на особые доски, к-рьш по мере наполнения снидтаются; катушки с наклеенными этикетами. просматриваются и затем отправляются в упаковку. При упаковке швейные катушки заворачивают в бумагу сначала по дюжинам в пачки, а затем по пол у гроссам (по 72 штуки), перевязывают вязкой и укладывают в деревянные яшики. Главнейшие свойства швейных ниток- крепость и гибкость, к-рые необходимы для успешной работы швейной машины. Крепость ниток зависит от свойства одиночной иряжи, гл. обр. от свойств сырого материала-хлопковых волокон, более длинных и тонких в хороших сортах; крепость зависит также от круток одиночной пряжи и от круток при кручении (предварительной и окончательной). Крутка влияет и на гибкость нитки: слишком крутые нитки не будут гибкими. В табл. 2 приведены нормальные крутки для швейных ниток, принятые на Ленинградских ниточных ф-ках. Табл. 2.-Нормальные крутки для швейных машин.
Ленииградтекстилем найдена такая ф-ла для стандарта крепости швейных ниток: где Р-разрывное усилие двух нитей, С- произведеиие крепости двух нитей на приведенный действительный номер суровой пряжи, N-действительный номер одиночной нити, п-число сложений, к-коэф. укрепления от полировки. Для глянцевых ниток к= 1,151,20. При зажимной длине на динамометре в 250 мм крепость швейных ниток в 6 сложений (в кг) по этому стандарту получается следующая: Номинальный номер I 36 Действительный номер .........35Л Разр. усилие двух ниток в кг.....4,51
Кроме производства швейных ниток из хл.-бум. пряжи существует производство ниток из льняной и пеньковой пряж. Большинство льняных и пеньковых ниток идет для рыболовных сетей; кроме того льняные и пеньковые нитки идут на обувные ф-ки для шитья обуви, а льняные-и в швейные мастерские. Соответственно этому льняные нитки разделяются на рыболовные, сапоях-ные и портновские нитки, а пеньковые-на рыболовные и сапожные. Для выработки рыболовных ниток льняная или пеньковая пряжа перематывается на сновальные катушки или наматывается в форме бобин крестовой мотки; как в том, так и в другом случае пряжа проходит через чистители для очищения от шишек и утолщений, к-рые очень вредно отзываются при механич. работе сетей. После очищения нрялга скручивается на рогулечных или кольцевых крутильных ватерах; кручение ггроизводится здесь ординарное, а не двойное, с предварительным трощением или без тролюиия. Для выработки сапожных ниток (дратвы), от которых требуется особенная крепость, употребляется льняная прялса из особо крепких льнов, а также пеньковая прялса. Сапожные нитки работаются с предварительным трощением и скручиваются на специальных крутильных машинах, на которых веретена получают движение от шестерен, благодаря чему достигается очень равномерная крутка. Портновские нитки работаются с двойным кручением так же, как и швейные нитки из хл.-бумажной пряжи. Льняные и пеньковые нитки выпускаются с ф-к в форме мотков (талек). Лит.: Коробанов А.С, Н а с е к и н Н. А., Смирнов К. Д., Крутильное и ниточное цро-изводство, Ив.-Вознесенск, 1927; Белдовский А. К., К рационализации ниточного производства, Труды 1-го Всесоюзного съезда по рационализации в текстильной промышленности 19-24 мая 1926 г. , М., 1926; Штуцер В. П., Организация льняного ниточного производства, там же. Н. Насекин. НИТРАЗОЛ, стойкий препарат диазосоединений, смесь сернокислой соли п-нит-рофенилдиазония с сернокислым магнием MgSOj и бисульфатом натрия NaHSOi (фирмы Кассела); получается при диазотиро-вании п-иитроанилина в сернокислой среде и добавлении к кислому раствору окиси магния и сульфата натрия. По принципу похож на, нитроз амин (см.), азофор (см.), пар-анил (нафталинсульфокислая соль п-нитро-фенилдиазония) и т. и. (см. Крашение). НИТРАТЫ, соли и эфиры азотной кислоты общей ф-лы M-NOg (где М-однова.лентный металл или органич. радикал). Описание отдельных Н. см. в статьях о соответствующих металлах. НИТРИДЫ, соединения азота с металлами и некоторыми металлоидами (бор, кремний), неплавкие вещества, частью кристал-.лические, частью аморфные, б. ч. устойчивые при высоких t°.H. могут быть пол5е-ны: 1) нагреванием металлов в струе азота при t° 800--900°; металлы поглощают азот, образуя при этом либо вполне определенные химические соединения (например MggNa, A1N, Ca3N2 и др.) .либо твердые растворы (Мп, Сг, Ti); с нек-рыми метал.лами (Mg, Са) реакция образования П. протекает весьма .легко и м. б. применена для связывания азота при выделении благородных газов из воздуха; 2) действием азота на карбиды металлов; 3) восстановлением окисей металлов углем в струе азота. Н. легко разлагаются при нагревании с легко восстанавливающимися окисями металлов (РЬО, СиО). При действии воды Н. б. ч. разлагаются с образованием аммиака. Расплавленные щелочи вьщеляют из П. аммиак. Относительная легкость соединения азота с металлами и дальнейи]ее разложение получаемых Н. с образованием аммиака были испсльзованы для фиксации атмосферного азота в промышленном масштабе. Наиболее применимым для этой цели оказался Н. а.люминия, получаемый по способу Серпека-нагреванием смеси боксита с коксом в атмосфере азота (см. Алюминий). За последнее время для получения аммиака через Н. алюминия предложен ряд алюминиевых сплавов, получаемых восстановлением бокситов. Состав этих сплавов ко.леблется примерно в следующих пределах: 25-46% 19-30% Si, 1-3% Т1 (остальное-Fe). Сплав нагревается в токе азота в присутствии катализаторов-хлоридов и флюоридов алюминия, магния, кальция и др.; особенно пригодньгмс оказался криолит в количестве ок. 1%. Реакция образования Н. алюминия из металлических сплавов протекает с выделением большого количества тепла, что вызвало предложение добавлять сп.лавы А1 к смеси бокситов и угля с це.лью уменьшения количества подводимого извне тепла за счет экзотермич. реакции образования Н. алюминия из метал.лич. алюминия; вместе с тем повышается и количество об1)азовавшегося H. алюминия. Однако трудно предположить, чтобы нитридный способ получения аммиака оказался в состоянии конкурировать со способом контактного получения аммиака из элементов. О Н. бора, магния, лития и др. см. статьи 0 соответствующих элементах. Лит.: UUm. Enz., В. 1, 2 Aufl., р. 277-28П, В. 8, 1 Aufl., р. 520-521. П. Коржев. НИТРИЛЫ иизонитрилы (карби.л-амины), соединения органич. радикала с остатком сини.льной (цианистоводородной) к-ты-циангруппой -CN, или изоциангруп-пой, -NC. Углеродный атом органич. радикала в Н. связан с углеродным атомом циангруппы; в изонитрилах-с атомом азота (согласно современным воззрениям углеродный атом в изоциангруппе считается двува-.ттентным). Т. о. общие ф-лы Н. и изонитри-лов выражаются--для Н.: R-C: :N, для изо-нитрилов: R-N - С. Способы получения Н.:1) действием цианистых солей на галоидные а.лкилы, например CH3J + KCN = KJ+CH3CN; 2) нагреванием со.лей алкилсерных кислот с цианистым калием: R-O-SOsK + KGN = RCN + K2SO4; 3) отнятием воды от аммонийных со.лей жирных кислот (I), от амидов кислот (II) и альдоксимов (III): I. R.COONH4 -2H20 = RCN, II. R-C0NH2 - H..O = KCN, III. R.CH:NOH- H20=RCN. H.-нейтральные вещества. При нагревании их со щелочами и.ли к-тами сначала проис- ходит присоединение одной молекулы воды с образованием амидов, а затем второй молекулы, причем получаются аммонийньи соли карбоновых кислот-реакция, обратная реакции получения Н. из аммонийных солей и амидов: RCN + 2II2O = R COONH4. Н. восстанавливаются металлич. натрием и спиртовом растворе до первичных амино!;: RCN-f-2H2->R-CH2-NH2. Н. присоединяют сероводород, хлористый водород, с образованием тиоамидов, имид-хлоридов. При действии алкоголей на Н. в присутствии НС1 образуются иминоэфиры: при аналогичной реакции с меркаптанами получаются иминотиоэфиры. Н. легко поли-меризуются. Низшие Н.-бесцветные жидкости. Н. жирного ряда обладают уд. весом в пределах от 0,78 до 0,83; слаботоксичны. Ацетон и трил (метилцианид), CHg-CN,- жидкость с t°nun. 81,5°, удельный вес при 0° равен 0,85. Вензонитрил (цнанбен-зол), CeHs-CN,-лшдкость с fuvn. 191°, / замерзания-13°;удельный вес 1,006 при 20°: содержится в небольших количествах в каменноугольном дегте; м. б. получен синтетически по способу Зандмейера-действием цианистого калия на дпазосоединение в присутствии солей одновалентной меди. И 3 о Н и Т р и л Ы -жидкости с t°Kim. НИЖ< соответствующих им П.; обладают сильным отвратительным запахом и значительной токсичностью (в особенности метилизонитрил. CHg-NC, ядовитостью превосходящий синильную к-ту); см. Синильная кислота. Способы получения изонитри-.лов: 1) действием цианистого серебра на галоидные алкилы: AgCN -f- CH3J = AgJ -f- CH3NC; 2) действием х.лороформа на первичные амины в спиртовом растворе., в присутствии едких щелочей. Процесс протекает по ур-ик : R-NHa -Ь CHCI3 = RNG + 3HC1; эта реакция, вследствие весьма сильного неприятного запаха, свойственного изони-трилам, является чувствительной пробой на первичные амины (реакция Гофмана). При действии разбавленных минеральных кислот изонитрилы омыляются с образованием аминов и муравьиной к-ты: R-NC + 2Н2О = R-NH2 + НСООН. Окисление изонитрилов приводит к образ! >-ванию эфиров изоциановой к-ты, R-N: С: О. Соединяясь с серой, изонитрилы образуют изотиоциановые эфиры-т. н. горчичн. масла: R-N:C + S = R-N:C:S (см. Горчичные эфирные масла и Аллиловог горчичное масло). Вследствие присутствия в мо.лекуле ненасыщенного (двувалентного) атома углерода изонитрилы обнаруживают тенденцию к присоединению галоидов, га-.лоидоводородов, серы, воды и других веществ. При t° 230-255° изонитрилы перегруппировываются в Н. Лит.: Чичибабин А. Е., Основные нача.ы органич. химии, 3 изд., М.-Д., 1931; Meyer Л'. U. Jacobson р., Lehrbuch d. organ. Chemie. В. 1-2, в., 1922-24. П. Коржев. НИТРИРОВАНИЕ, см. Нитрование. НИТРИТЫ, соли и эфиры азотистой кислоты общей формулы M-ONO (где М - одновалентный органический радика..л и.ли ме- талл); описание отдельных Н. помещены в статьях о соответствующих металлах. НИТРОЛНИЛИНЫ, моно-,ди-, три- и тетра-нитропроизводные анилина (аминобензола). М о и о н и т р о а и и л и н ы, состава КО. Cell4-NH2, щироко применяются в анило-красочной и химико-текстильной промышленности как промелгуточные продукты для <л1птеза красящих веществ. В зависимости от взаи.много расположения ад1ино- и нитро-1руппы известны след. три изомера нитро-анилина, пара-, орто-, и мета-Н.; из этих изомеров наибольший практический интерес представляет и-изомер. Способ получения п- и о-Н. в иринципе одинаков. В технике получение их осуществляется двумя путями. Первый, более старый, но применяемый и в настоящее время, состоит в нитровании какого-либо анплида и пос.тедующем отщеплении ациль-иого остатка. В зависимости от Г-ных условий реакции, характера ацильпого радикала и от среды реакции, соотношения о- и п- изомеров варьируют. Так, ири наиболее уиотребите.чьном нитровании ацетанилида в сернокислой среде при темп-ре 2-3° получаются значительные (свыше 90%) количества и-изомера. Повышение Г реакции вызывает увеличение выхода о-изомера. Точно так же замена серной кислоты уксусною приводит к образованию значительных выходов о-изо-\repa. Если вместо ацетанилида нитрованию подвергаются формаиилид или оксанилид, то получается почти исключительно г-изоме}) в первом случае и о-изомер во втором. Непосредственное нитрование незащищенного анилина не применяется вследствие .легкой его окисляемости. Лишь в а.лкилзамещенных производных ани-лина, как диметиланилин, это возможно, причем в сильно кислой среде получают до 50% .к-изомера. Полученные нитроацетанилиды отделяются технически вследствие различной омы.ляемости аце-тил-w-H. и ацетил-о-Н. Последний, омыляя ацетильную группу, переходит в о-Н. уже при действии кипящего раствора соды. При этом о-Н. переходит в раствор, из которого по ох.лаждении 111лкристаллизовывается. j-Изомер омыляется только нри действии щелочи. Второй способ получения п- и о-Н. состоит в обработке аммиаком при t° около 200° в авток.лаве п- или о-нитрохлорбензо.ла. Хотя этот способ представляет значительные выгоды, однако фабрикация Н. ио этому способу оказывается бо.лее затруднительной вследствие необходимости ирименения высоких давлений. П а р а-п и т р о а и ил и и - лсе.лтый кри-л'аллич. порошо1с С t° 147°, ма.ло х)астворим в воде, .легко--в спирте и других орган, растворителях, дает растворимые в воде соли с. минеральны.чи к-тамгг; широко применяется в анилокрасочиой промьппленности как променсуточный продукт и в химико-тек-стильноГг про.мьип.ленности д.ля ледяного кра-П1енпя и обработки красителей на волокне (см. Крашение). Красочные ф-ки выпущсают стойкие препараты лиазотп})ованного п-Н. (ем. Питразол и Нитрозамины). О р т он и т р о а и и .л и п-желто-оранжевый поро-пгок с Р 71,5°, слегка растворим в горячей воде, перегоняется с водяными парадгь'; находит применение для получения о-фени-лендиамина и в ледяном крашении. М е т а-нитроанилин - л^е.лтый порошок с *° ,. 114°, легко растворим в горячей воде; получается при неполном восстановлении сернистым натрием .м-динитробензола. Применяется при производстве азокрасителей и в ледяном крап1ении. Лит.: Ворожцов Н. Н., Ступени в синтезе красителей,л., 1926; Fierz-David H.E.,Grund-legeude Operationen d. Farbencliemie, 3 АиП., BerHn, 1924; Groggins P. H., Aniline a. its Derivatives, h., 1924. И. Иоффе. Из д и II и т р о а н и .л и и о в CeH3(NОг)г (NHg) технич. интерес представляет лишь 2,4-д и и и т р о а и и л и н. Он образует желтые с голубоватым б.леском кристаллы с f°, 188° и по.лучается нагреванием под давлением 2,4-дпнитрохлорбензола с раствором аммиака; служит для но.лучения азо-красителен, причем диазотированием б проведено лишь в копц. сернокислом растворе в виду слабо основного характера этого соединения. 2,4, 6-Т р и и и т р о а и и л и н, пикрамид. CeH2(NOaVNH2) - темнолселтые моноклинические таблички с голубоватым б.леском. п.лавящиеся при 188°.Тринитроанилии .легко получается действием аммиака на трини-трохлорбензол; ио своим взрывчатым свойствам он близок к пикриновой к-те; преимуществами его являются нерастворимость в воде, отсутствие кислотного характера и красящей способности; технич. применения почти не получил. 2,3, 4, 6-Тетранитроанилин, CeH(N0a)4(NHg)-желтый кристаллический порошок, плавящийся с разложением при 210-212°; t° вспышки 231-233°. Он м. б. получен непосредственным нитрованием анилина смесью азотной и серной к-т с добавкой калийной селитры, но при этом образование о- и w-изомеров понижает выход. По способу Флюршейма Н в качестве исходного продукта пользуются лг-нитроанилином и П'-дзергают его дальнейшей нитрации. Тег-р гнитроанилин по взрывчатым свойствам о ЛИЗОК к тетрилу; его недостатком является малая химич. стойкость, пробы Эбля (Abel) он пе выдеряшвает. По англ. данным при соответствующей очистке стойкость тетра-нитроанил'ина выше, чем тетрила. В бомбе Трауцля тетранитроанилин дает расширение в 430 см. Тетранитроанилин ирименяет-ся г.лавн.обр. для снаряжения детонаторов. См. Взрывчатые вещества. Лит.: 1) г. П. 241697/10.-К а s t Н., Spreng-п. Zundstoffe. Brschw., 1921; С о 1 v е г Е. de W. S., High Explosives, London, 1918; S t e t t b a с h e г A., Die Schiess- u. Sprengstoffe, Lpz., 1919; IJllmanns Enzvkloradie, B. 1, 2 Aufl. A. Горст. НИТРОБЕНЗОЛ, CgHs-NOa, простейшее питросоединение ароматического ряда,- бледножелтая ясидкость, замерзающая при 8,4°; 210,8°; уд. вес 1,21. И. получается при нитровании (см.) бен-зо.ла по ур-ию: CeHe+HN03=C6ri5N02+H20 +36,6 Cal, причем выделя10П1аяся при реакции вода д. б. связана каким-.либо водоотпимающим средством; в технике для этого применяется серная кислота. Степень нитрования бензола, как и других ароматич. углеводородов, зависит от t° реакции и от крепости нитру- ющей смеси. При нитровании бензола в Н. оптимальной t° яв.ляется 45-55°; повышение может привести к образованию динитро-бензола; понижение t° препятствует доведению реакции до конца, оставляя тем самым часть бензола без изменения. Еще большее влияние на выход Н. оказывает крепость нитрующей смеси; практически было найдено, что количество серной к-ты, вводимой в нитрующую смесь, д. б. таким, чтобы серная к-та, связав всю воду, дала по окончании реакции т. н. отработанную к-ту с содержанием 77-78% H2SO4. Исходя из этого, можно составить нитрующую смесь из технических серной и азотной к-т различных концентраций, пользуясь следующими соображениями. Количество азотной к-ты берется теоретическое (д.ля нитрования до мо-нонитропродукта) с прибавлением--2% для полноты реакции. Т. о. нри концентрации азотной к-ты, равной а% HNO3, потребное ее количес1во х для нитрования 1 кг-мол. (78 кг) бензола будет 63 102 При концентрации серной к-ты, равной Ь% HaSOi, потребное ее количество у должно, связав всю воду, дать крепость отработанной к-ты в 77-78%, при которой отношение H2S04:H20 = 3,5. Всего в реакцию введено 63 102 100 - а 100 - ъ а ~1оо С азотн. к-той, у кг с серной кислотой, и 18 кг НдО выделяется при самом нитровании. Следовательно Ъ о Г63 . 102 3,5 р а 100 - а , 100 - Ь , о1 + -ioo- + i8j; у можно вычислить, подставив значения а и Ъ. При соблюдении этих условий для обычных технич. к-т в нитрующей смеси содержится ~ 60% H2SO4, 32% HNO3 и 8% НаО. При нитровании других углеводородов расчет нитрующей смеси ведется так же, однако про-хдентное содержание H2SO4 в отработанной H2SO4 в каждом отдельном случае меняется. При технич. получении Н. заранее приготовленная и охлажденная нитрующая смесь при.ливается к бензо.лу при перемешивании. Скорость приливания регулируется в зависимости от t° реакционной массы. Реакция нитрования бензола экзотермична (-f36,6 Cal); кроме того тепло выделяется в результате разбавления серной к-ты образующейся при реакции водой, так что нри нитровании выделяется в среднем ~ 40 Cal на 1 г-моль бензола. В виду этого нитрование веДут в наружно охлаждаемых аппаратах. В зависимости от способа охлаждения (вода, охлаждающий рассол) скорость приливания нитрующей смеси, а следовательно и скорость нитрования, бывают различны; летом скорость нитрования значительно меньше, чем зимой в той же обстановке, что необходимо принимать во внимание при проектировании нитрационных установок. Вследствие той же экзотермичности реакции констру1Щия нитратора играет значительную роль. Т. к. бензол и нитробензол нерастворимы в разбавленной серной к-те, реакция нитрования должна итти между двумя несмешиваюпщмися жидкостями. Для устранения местных перегревов на поверх- ности раздела двух фаз необходимо энергичное перемешивание (эмульгирование) смеси. Нитратор для бензола представляет закрытый сосуд, имеющий рубашку для охлаждения и снаблгенный трубами для приливания нитрующей смеси, для введения сжатого воздуха и выдавливания реакционной смеси, люком для ремонта и взятия проб, термометром и мешалкой с сальником. Для изготовления нитраторов до сих пор применялся литой чугун; в последнее время предложены нитраторы из алюминия, свободного от SiOg. Для увеличения поверхности охлалодения нитраторы конструируются с волнистой боковой поверхностью и с внутренними охлаждающими стаканами, или цилиндрами. Применение стаканов в соединении с винтовой мешалкой способствует усиленному перемешиванию смеси, т. к. имеет место не только перемещение жидкости по кругу, но и подъем ее внутри стакана с последующим переливанием снаружи его. Точно так же волнистая поверхность способствует лучшему разбиванию и смешению жидкостей. Конец нитрования определяется по контрольной пробе. При наличии непрореа-гировавшего бензола или HNO3 добавляется соответствующее количество другого компонента, и реакция доводится до конца. После нитрования вся смесь из нитратора выдавливается в делительные воронки, где верхний слой Н. отделяется от отработанной к-ты, которая либо регенерируется либо идет на другие химич. производства. Оставшийся кислый Н. может быть промыт водой и очищен перегонкой или непосредственно пущен на дальнейшую обработку. За последние годы предложены интересные методы непрерывного нитрования и нитрования в парах, еще не получившие технич. осуществления. Н. имеет широкое применение как первая ступень обработки бензсла для изготовления ценных промежуточных продуктов для синтеза красителей (анилин, бензидин и др.). Самостоятельное значение Н. имеет как суррогат миндального масла, выпускаемый в продажу под названием мирбанового масла для отдушки дешевых сортов мыла. В небольших размерах Н. используется как растворитель. Лит.: Ворожцов Н. Н., Ступени в синтезе красителей, Ленинград, 1926; его же. Основы синтеза красителей, М.-Л., 1925; G-roggins Р. Н., Aniline and its Derivatives, L., 1924; S с h u 11 z G., Chemie d. Steinkohlenteers, B. 1, Die Rohmaterialien, 4 Aufl., B. 1, Brschw., 1926; Fierz-DavidH.E., Grundlegende Operationen d. Farbenchemie, 3 Aufl., в., 1924. И. Иоффе. НИТРОВАНИЕ, введение в органич. соединения нитрогруппы NOa; эта реакция широко применяется при технич. получении нитросоединений ароматич. ряда и для получения азотных эфиров алифатического ряда (клетчатки, глицерина). Н. состоит в замене водородного атома нитрогруппой. Нитрующим средством служит обычно азотная к-та, в большинстве случаев в присутствии серной. Реже применяют смесь азотнокислых солей (селитры) с серной к-той. Нитрогруп-пу можно вводить также при помощи жидкой четырехокиси азота (N2O4) или газообразной двуокиси (NOa) в присутствии AICI3, причем как промежу^точный продукт обра- зуется комплексное соединение, напр. в случае бензола-2А1С1з-ЗЫ02-ЗСвЫв. Н. протекает по следующему общему уравнению: R.H+H0.N02= R.NO2+H2O. В действительности реакция протекает сложнее, что зависит от неодинаковой способности веществ к Н., различной их стойкости в отношении побочных реакций, всегда ослслоняющих основной процесс. Так напр., применение разбавленной HNO3 может вести к окислению; крепкая HNO3 действует иногда слишком сильно. В этих случаях крепкую HNO3 разбавляют другой к-той, не оказывающей вредного влияния на течение Н.; в качестве таковой применяют конц. HjSOt, гораздо реже-уксусную к-ту. Серная к-та при Н. является не только растворяющей или разбавляющей средой, но, благодаря ее сильной водоотнимающей способности, и средством, связывающим воду, выделяющуюся при реакции. Из ириведенного выше основного уравнения реакции Н. видно, что на каждый моль HNO3 выделяется один моль воды. Это наконление воды делает в конце концов азотную к-ту неактивной. Например установлено, что при Н. клетчатки реакция идет только в присутствии моногидрата, HNO3, т. е. метаазотной к-ты, и что всякое взаимодействие азотной к-ты с клетчаткой прекращается, когда в реакционной смеси образуется гидрат HNOg-HgO (ортоазотная кислота). В таких случаях вступает в действие H2SO4 и связывает реакционную воду,де-лая ее безвредной для течения процесса Н. Применение H2SO4 при Н. позволяет пользоваться более слабой,а следовательно и более дешевой азотной к-той и вести реакцию в известных случаях с точно рассчита-лными количествами HNO3. Иногда обработку серной кислотой предпосылают Н., т. е. нитруемое (ароматическое) соединение предварительно сульфируют и затем, действуя азотн. к-той, вытесняют сульфогруппу -SO3H нитрогруи-пой. Предварительное сульфирование часто облегчает ведение Н. Так, сульфофеноловую 1-ту удается обратить в пикриновую при помощи 60%-ной HNO3, между тем как Н. ди-иитробеизола высокопроцентной HNO3 и дымящей H2SO4 дает лишь самые незначите.ль-ные количестватринитробензола.Роль H2SO4 не исчерпывается водоотнимающей ее способностью. При Н. клетчатки вероятно имеет -место образование эстеров H2SO4 (т. н. цел-люлозосерной к-ты), прргаем эстеризованные гидроксилы оказываются т. о. предохраненными от Н. и ири последующей промывке водой они вновь образуются. При Н. ароматич. соединений H2SO4 в известной мере направляет течение реакции. Судя по всему, вхождению нитрогруниы предшествует образование продукта присоединения HNO3, причем от э^гого промежуточного продукта м. б. отнята либо частица воды с образованием нитропродукта либо частица HNO3 с образованием фенола. Прибавление H2SO4 уменьшает вероятность образования фенолов и повышает выходы нитропродукта. Что касается количества H2SO4, требуемого для процесса П., то обычно ее берут столько, чтобы в конце Н. концентрация ее м. б. выражена ф-лой НабОл-ЬгНгО. При Н. ами- j г. Э. т. XIV. но-, сульфр- или нитросоединений с предварительным растворением их в HgSO количество последней эмпирически берется такое, чтобы обусловить образование гомогенного раствора. Большой избыток H2SO4 (иногда олеума-дымящей серной к-ты) применяют при введении следующих за первой нитро-групп-операции, значительно более трудной по сравнению с получением мононитро-ироизводпого. Наконец иногда избытком серной к-ты, значительно превышающим рассчитанное количество, придают иное направление реакции. Так, при Н. а-мононитрона-фталина с больши.м избытком HgS04 наблюдается появление изомера динитронафтали-на, обычно ие получающегося; при Н. анилина в присутствии конц. H2SO4 получается смесь трех возможных нитроанилинов; при применении же десятикратного количества H2SO4 образуется 10-15% о-нитроанилина и поровну .4- и п-нитроанилина (от взятого в реакцию анилина). При пятидесятикратном количестве H2SO4 увеличивается получение jn-соединения за счет о-соединения при остающемся постоянном количестве w-coe-динения. Концентрация HNO3 для Н. колеблется, в зависимости от требуемой степени Н., примерно от 72 до 94%, считая на моногидрат HNO3. Смесь HNO3 и H2SO4 носит название нитрующей смеси. Для приготовления ее пользуются HNO3 указанной выше крепости и конц. H2SO4-т. и. купоросным маслом или олеумом. Отношение HNO3 и H2SO4 обычно не превышает 1:3. Количество нитрующей смеси по отношению к весу нитруемого вещества, в зависимости от природы и условий Н., бывает различно: при Н. клетчатки нормально оно бывает равно 1:50; в случае ароматич. соединений, напр. при И. толуола, в зависимости от крепости к-т оно выражается от 1:8 до 1:14. Самым существенным фактором при Н. является содержание воды в нитрующей смеси; от этого последнего зависит степень нитрации, что можно видеть из состава смесей, применяемых хотя бы при Н. толуола: Нитрование толуола. t Состав ргитрую-Исходное I щей смеси в% вещество , H2SO4 HNOs НаО Толуол .... Нитротолуол . Динитротолуол 55 65 80 25 30 20 Главный продукт нитрования Нитротолуол Динитротолуол 1 Тринитротолуол При Н. клетчатки-смесь, содерлсащая 66,5% H2SO4, 22,5% HNO3 и 11 % HgO дает нитроклетчатку с 13,1% N; смесь же 61% H2SO4, 23% HNO3 и 16% Н2О-с 12% N дает т. и. коллодионный хлопок. Помимо концентрации к-т весьма важным фактором при Н. является t°. Повышение Г подобно разведению HNO3 влечет за собой усиление окисления и понижение нитрующего действия смеси, но на состав получающихся нитронродуктов бо.льшого влияния не оказывает. Реакция Н. экзотермична, поэтому для поддержания t° в определенных границах приходится прибегать к внешнему охлаждению, ио под конец иногда допускают нагревание, чтобы довести Н. до конца при малой концентра- НИТРОВАНИЕ 58а ции оставшейся HNO3. Вместо нагревашш чаще оставляют реакционную смесь на некоторое время стоять и после этого ужо выделяют продукт. С целью уменьпп1ть вредное влияние местных повышений t° от теплоты реакции прибегают к энергичному перемешиванию реагирующих веществ. Для Н. то-луста t° не должна превышать: при получении мононитротолуола-30°, динитротолуо-ла - 60-1-90° и тринитротолуола- 95-М 10°. При Н. клетчатки влияние t° сказывается на скорости реакции и на образовании .легко растворимых в смеси спирта с эфиром ни-троклетчаток; на содержание азота температура не влияет. Например обработка клетчатки смесью 61% H.S04, .34% HNO3 и 5% Н2О при различных температурах дала такие результаты: t°............+40° +30° +18° -18° Nb%.........13,19 13,20 13,10 13,33 Влияние катализаторов на реакцию Н. пока 5ще недостаточно изучено. Известно только, что прибавление Hg и ее солей к смеси ароматич. производного и HNO3, а равно и других кислородных соединений азота(N2O4, N.2O3, смесь HNO3+N2O4) вызывает наряду (; введением одной или нескольких нитро-групп также и окисление водорода ароматического ядра, в результате чего получаются нитро- (или пслинитро-) фенолы. Таким путем молено из бензола . получить динитро-фенол и пикриновую к-ту. Отработанные к-ты, в зависимости от содержания в них неиспользованной HNO3, идут после исправления их олеумом и крепкой HNO3 вновь на Н. или, при'пебо.ль-ших количествах последней, поступают на депитрационные установки, где подвергаются разделению, или непосредственно направляются на производство H2SO4; наконец в нек-рых случаях отработанные к-ты используются длярастворения фосфатов. Иногда Н. ведется без водоотнимаюшего средст а, тогда нет необходимости прибегать к H2SO4, и применяют разведенную HNO3. Напр. фенол, будучи обработан разведенной HNO3, дает смесь п- и о-нитрофенолов. Легкость течения реакции в этих случаях обуслов;п1-вается главн. обр. активирующим влиянртем групп ОН или NHg, которые делают ароматич. ядро более реакциеспособным. Оригинальный способ Н. был предлолсен химич. ф-кой Грюнау; он заключается в использовании Д.ЛЯ Н. нитрозных газов и.ли окислов азота в том виде, как они получаются при производстве синтетич. азотной к-ты по дуговому способу. Смесь окислов азота с воздухом проводят через ZnO, поглощающую их и отдаюп1ую затем при нагревании. С парами бензола нагретое соединение цинка реагирует, переводя его в нитробензсл. Толуол при этом нацело превращается в смесь 11% м- и 89% о-нитросоединения. Н. а .л и ф а т и ч е с к и X сое д и нений в технике проводится толысо с немногими веществами, гл. обр. с глицерином и клетчаткой , причем образуются не питросоедиие-ния, а эфиры азотной к-ты. Так, глицерин при Н. дает тринитрат C3H5(ON02)3, называемый нитроглицерином (см.) . Сложнее обстоит дело с клетчаткой. В ее молеку.ле, ес.ти придавать псследпей ф-лу (CgHioOj,практи- чески м. б. введено от 4 до 11 групп O.NOg, причем получаются продукты с содерланием N от 6,76 до 13,5%. Теоретически возмолшая 12-азотная питрохслетчатка с содержанием 14,14% N еще не бьша получена. Наивысшая достигнутая степень Н.-13,91% N (Эдер). Трудность получения 12-азотпой нитроклетчатки состоит в том, что (если принять д.ля клетчатки структурную формулу 1 рина) при сочетании радика.лов в цепь один из гидро-КСИ.ЛОВ оказывается в третичном полон^ении, что отражается на его способности к эстери-фикации. Имеется це.лый ряд попыток подвести теоретич. обоснование под пропессы, имеющие место при Н. к.летчатки [i,]. На этиловый спирт HNO3 действует окисляющо исключительно энергично; если реакция ведется в присутствии Н£ (КОз)2, то в резу.льтате сложной, еще не вполне выясненной реакции получается ртутная соль гремучей к-ты. Сахар в присутствии окиси молибдена как катализатора переводится HNO3 в щавелевую к-ту; однако этот способ не нашел технич. применения. Н. а р о м а т и ч е с к их соединений производится в значительно бо.льших размерах, чем алифатических, т.к. образующиеся при этом нитросоединения (нитробензол, ни-тронафталин, динитробензол, хлординитро-бензол и др.) находят широкое применение в качестве важных исходных материалов для по.лучения красящих и взрывчатых веществ. Н. ведется путем введения нитруемых веществ в смесь HNO3 и H2SO4, или, наоборот, HNO3 приливают к веществам, растворенным в конц. H2SO4. В то время как замещение всех водородных атомов в бензоле бромол! и.ли хлорол! достигается легко, до сих пор не удалось прямым П. ввести в бензол или в его производное больше трех ни-трогрупп. В замещенный бензо.л введение нитрогрупп происходит тем легче, чем большее число водородных его атомов замещено. Если в бензольном углеводороде имеется лишь одна боковая цепь, то нитрогруппа вступает по отношению к ней преимущественно в о- и п-, но не в л1-положение.Такое л^е направляюище влияние на нитрогруип\ (в положения о-ип-) оказывают следмощис радикалы: -CII3: -С1(Вг, J); -ОН; -ОСН3: -NH СО - СНз; -NH SO2 - СеНд. Например при П. фенола получаются о- и п-нитрофе-нолы. Напротив, в ароматических соединениях, содержащих альдегидную (-СНО). карбоксильную (-СООН), циан (-CN) или сульфогруппу (-SO3H), нитрогруппа по. отношению к ним б. ч. занимает .ги-иоложе-ние. То лее д. б. сказано об имеющейся улсе в ядре нитрогруппе: вторая и третья нитрогруппы занимак-)т по отношению к ней ж-нололеение (если таковое свободно). В мо-ноиитроуглеводородах нитрогруппа чрезвычайно прочно связана с бензольным кольцом н пе м. б. прямо замешена д])угой группой атомов. В полипитросоединёниях или галоидонитрос(№дипениях, напротив, нитрогруппы проявляют больп1у10 подвижность и часто допускают непосредственное замещение их другими остатками. Напр. о-питро-бензо.л при кипячении с NaOH дает о-нитро-фенол. а о-бромнитробензол при пагреваиии с NH4CI при 120° дает о-дихлорбеизол. Выделение продукта Н. ароматич. соединений производится обычно выливанием смеси в холодную воду или на толченый лед; этого бывает достаточно для выпадения продукта, если он не растворим в воде и разбавленных к-тах. В противном случае продукт из кислого водного раствора вьюаливают поварен-иой или глауберовой солью. Если в продукте Н. много сульфогруни, то иногда и этот способ не дает желаемых результатов; в таких случаях прибегают к выделению продукта в виде кальциевой соли {си.Сульфирование). Лит.: 1) М а ш к и н А., Нитрацип клетчатки, М., 1926; 2) Сапожников А., Теория нитрации клетчатки, Я{ , 1910.-в о р о ж ц о в Н., Основы синтеза красителей, М.-Л., 1925; Ullm. Enz., В. 5, р. 521; .Smidt J., Lehrb. d. organ. СЬзпйе. 4 Aufl., Stg., 1929; KastH.,Spreng-u. Zundstoffe, Brschw., 1921; V-olgt A., Die Herstellung d. Sprengstoffe, Halle a/S., 1913; Will, .Mitteil. a. d. ZentralsteHe f. Wis-senschafttechn. Unti;rsuchungen, Neubabelsberg, 1900; Schaarschmidt, B , 1924, B. 57, p. 2065; Spiegel L., B , 1926, В., 59, p. 202. B. Нарасев. НИТРОГЛИЦЕРИН, гл ицер ин-тринитрат, азотнокисл. эфир глицерина С3Н5(0-К02)з-Впервые был получен А. Собреро в 1847 г. действием смеси серной и азотной кислот на глицерин: СзН5(ОН)з+3 НКОз=СзН5(О.К02)з4-3 НоО. II.-маслообразная, в чистом виде почти бесцветная, обычно слегка желтоватая жидкость ж1уче-сладкого вкуса, ири обычной t° без запаха. Уд. в. жидкого Н. 1,601, твердого-1)1= 1,735 (стабильная форма); показатель преломления Wd= 1,4744; вязкость 7=2,5 (г} НаО=1). Н. мало летуч при обыкновенной t°, выше 50° летучесть значительна. Н. не м. б. перегнан без разложения даже в вакууме. Н. кристаллизуется в двух формах-стабильной (бипирамидальной ромбич. системы) с Г„.= 4-13,2° и лабильной (триклинной системы) с Г„.=-f-2,2°. Скорость самопроизвольной кристаллизации Ц. ничтожна: линейная скорость кристаллизации не превышает 0,4 мм/мин (стабильная форма при -3°). Для технич. Н. f° ,. и величина линейной скорости кристаллизации заметно ниже. Н. смешивается во всех отношениях с метиловым спиртом, ацетоном, эфиром, нитрогликолем, динитроглицерином и довольно хорошо растворяет нитропроизвод-ные и коллодионный хлопок, давая с последним б. или м. вязкие желатины. Растворимость в воде очень мала-1,8 г/л при 20°. Спиртовые щелочи омыляют Н., причем наряду с нитратом и нитритом щелочного металла получаются продукты окисления глицерина, гл. обр. ацетат и формиат. Серная к-та растворяет Н. с разложением, выделяя из него свободную азотную к-ту. Химич. анализ Н. обычно ограничивается опреде-.тением содержания свободной щелочи или кислоты и содерлсания влаги и азота (метод .Пунге). О специальных методах испытания Н. см. Взрывчатые вещества. При испытании на стойкость по пробя Абеля (Abel) время начала разложения при псышепной t° (65- 82°) наблюдается по появлению окрашивания от действия продуктов разрушения (окислов азота) иодокрахмальной бумажки. Чувствительность Н. к удару (пробой на копре): детонирует нри падении груза в 1 с высоты 10 ем (для замерзшего-40 cm). И. детонирует уже от капсюля № 3, но ско- рость детонации при этом равна 1 500- 2 ООО м/ск, для получения же максимальной скорости (7 450 .и/ск) требуется усиленный детонатор. В тве]>дом виде Н. в стабильной форме детонирует с повышенной скоростью (ок. 9 ООО .м,/ск) от двуграммового капсюля гремучей ртути; лабильная форма требует промежуточного детонатора. Теплота взрыва Н. равняется 1 485 Са1/кг, Г взрыва 3 470°, объем продуктов взрыва при нормальных условиях-712 л/кг. Фабрикация Н. производится путем нитрования чистого, т. н. динамитного, глицерина (1)15 б = 1,262, содержание воды >1,5%) смесью азотной и серной кислот в аппаратах систем Нобеля, Натана и Шмида (первые два - периодич. действия, последний - непрерывного). Нитраторы Нобеля и Натана представляют свинцовые баки с змеевиками для водяного охлаждения, наполняемые кислотной смесью; при заливке глицерина производится размешивание смеси воздухом. После нитрации в сепараторе происходит разделение Н. и отработанной к-ты вследствие разности уд. весов; затем Н. поступает на промывку водой и содовым раствором (2-3%-ным) при t° от 20° до 50°. Отработанная кислотная смесь после длительного отстаивания для полного выделения суспендированного Н. (3-10 дней) идет на денитрацию. В системе Натана сепарация происходит в нитраторе; специальным приспособлением устраняется увеличивающее опасность пропускание Н. через краны и в нитраторе и в промывных аппаратах. Кроме того в способе Натанд, добавлением после сепарации к отработанной смеси 2% воды увеличивается растворяющая ее способность по отисшению к П., так что не требуется последующего отстаивания. В системе непрерывной нитрации Шмида (см. фиг.) в циркулирующую в котле 1 отработанную кислоту поступают: снизу свелсая смесь 5, сверху-в среднюю часть аппарата--глицерин 3, сверху через боковую трубку 4 вытекает эмульсия отработанной к-ты и Н. Механич. перемешивание посредством мешалки 5 создает энергичную циркуляцию жидкости и позво.71яет располо-лоить значительно большую охлаяодающук поверхность з.меевиков 6 в единице объема. Сепарация ведется в специальном плиточном аппарате, где эмульсия идет тонкими слоями, что сокращает время практически полного разделения до двух часов. Промывной аппарат состоит из керамиковой колонки с сетчатыми горизонталь ньвии перегородками; кислый нитроглицерин, воздух и промывной 20 %-ный раствор соды при 20° поступают снизу; сверху выходит эмульсия стабилизованного И. в растворе сульфата и нитрата натрия; незначительная добавка анилина сокращает время промывки с 10 до 3 мин. Способ Шмида в силу автоматичио- 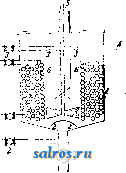 сти и уменьшенного количества Н. в системе (при данной производительности в 5-6 раз) тем самым обеспечивает ббльшую безопасность и экономичность производства. Выход Н. определяется гл. обр. составом и количеством кислотной смеси. При старых с о ставах типа: 3 6 % HN О з, 5 6,4 % Н .,8 О , 7,6% НаО и отношении кислотной смеси к глицерину 7,5 :1 выход Н. равнялся 200-205% от веса взятого глицерина вместо теоретических 246,7% (вследствие больших потерь на растворение Н. в отработанной кислоте); применение более концентрированных смесей увеличивает выход, и в настояшее время при составе смеси 50% HNO3 и 50% HaSOi и отношении смеси к глицерину 5:1 выход достигает 234-235%. Главное применение П. находит в динамитах, в нитроглицериновых порохах и (в меньших количествах) в виде добавок (3-4%) к аммиачно-селитренным взрывчатым веществам. В незначите.чьных количествах нитроглицерин применяется в медицине при болезнях сердца. Лит.: Guttmann, Die Industrie d. Explosiv-stoffe, Braunschweig, 1895; E s с a 1 e s R., Nitroglycerin u. Dynamit, Lpx., 1908; Naoum Ph., Nitroglycerin und Nitroglycerinsprengstoffe, Berlin, 1924; S t e t t b a с h e г A., Die Schiess- und Sprengstoffe, Leipzig, 1919; Kast H., Spreng-u. Ziindstoffe,Brschw., 1921; N a о u m Ph., Die Schiess- u. Sprengstoffe (Dynamite), Dresden-Lpz., 1927; eZtschr. f. das gesamte -Schiess- und Sprengstoffwesen*, Miinchen, 1906-30, в особенности 1906, 1908, 1914, 1927, 1930. A. Горст. НИТРОЗАМИНЫ, органич. соединения, содержащие китрозогруппу -N О, связанную не с углеводородным радикалом, а с замещенной аминогруппой, и имеющие строение N-N-О, где R-ароматич. остаток (преимущественно фенильный), а м. б. либо ароматическим, либо жирным остатком, либо атомом водорода. В первом случае Н. представляют продукты взаимодействия азотистой к-ты с вторичными ароматическими или жирно-ароматич. аминами и м. б. получены действием нитрита натрия в кислой водной или водноспиртовой среде иа соль вторичного амина (монометиланилнн, моноэтиланилин, дифенштамин и т. п.) либо действием амилнитрита на раствор амина в органич. растворителе. Н. являются нестойкими веществами, обладают специфич. запахом, плавятся значительно ниже изомерных с ними и-нитрозосоединений, в к-рые Н. переходят при действии абсолютного спирта, насыщенного НС1. Схематически получение Н. и их перегруппировка в нитрозосоедине-ния м. б. выражены следующими ур-иями (для npmviepa взят дифениламин): <(-NH-<( + но-N-0 ->Н20 +[<]]N--<(<(-NH---<NO. NO В случае, если в общей ф-ле П. R представляет собой атом водорода, Н. являются продуктами изомеризации антидиазотатов (см. Диазосоединения) по схеме R-N R-NH И 1 N-он N 0 И способны давать соли со щелочными металлами. Эти Н. получаются при действии креп- ких растворов щелочей на диазониевые соли; под действием к-т они способны переходить обратно в диазосоединения и в соли диа-зония. Этим свойством Н. пользуются в технике при ледяном крашении (см. Крашение ледяными красителями)для приготовления стойких препаратов диазосоеди-нений. Наиболее употребительным является Н., получаемый из w-нитрофенилдиазония в виде коричнево-желтого осадка, выпущенный в продажу герм, концерном I. G. под названием нитроз амин красный. Вследствие стойкости Н. их молшо смешивать с азосоставляющей и эту смесь наносить на ткань. Такие смеси выпускаются в продажу под названием рани д-к рас ит е л е й. Лишь при обработке к-той Н. переходит в способный к азосочетанию син-диазотат, а на ткани образуется азокра-ситель. Этот метод особенно применим для печатания волокнистых материалов. (См. Ситцепечатание). Лит.: Шапошников В. Г., Общая технология волокнистых и красящих веществ, М.-Киев, 1926; петров П., Викторов П. и Малютин П., Химич. технология волокнистых веществ, Ив.-Вознесенск, 1928. И. Иоффе. , НИТРОКЛЕТЧАТКА,СМ. Нитроцеллюлоза. НИТРОСОЕДИНЕНИЯ, органич. соединения, характеризующиеся наличием в составе молекулы одной (мононитросоединения) или нескольких (полинитросоединения) нитрогрупп -NOg. Общая формула Н. R-NOg, где R-органич. радикал, углеродный атом к-рого связан непосредственно с азотом ни трогруппы (считаемым обычно пятивалентным) в отличие от эфиров азотистой к-ты, изомеров Н., с общей формулой R-ONO, в ; к-рых радикал R связан непосредственно с атомом кислорода. Н. ароматич. ряда могут содержать нитрогруппу как в ядре(собствен-; но ароматические Н.), так и в боковой цепи; представители последней группы по своему химич. характеру и по способам получения аналогичны Н. жирного ряда. Жирные и ароматич. Н. различаются между собой по способам получения и по свойствам, а также по технич. значению. Способы получения. Н. жирного ряда образуются при действии солей азотистой кислоты (обычно серебряной соли) на галоидные алкилы: AgNOa + C2H5J - C2H5NO2 + AgJ. При этом кроме Н. частично образуются эфиры азотистой к-ты, которые кипят обыч,-но значительно ниже соответственных Н. и потому м. б. легко отделены от них простым фракционированием. Действие на углеводороды жирного ряда разбавленной азотной к-ты при нагревании иод давлением также приводит к образованию Н. Конц. азотная к-та непригодна для получения П., т. к. она окисляет углеводороды жирного ряда. Н. ароматического ряда получаются при действии либо одной конц. азотной к-ты либо смеси конц. азотной и серной к-т (т. н. нитрующей смеси) на ароматич. углеводороды (см. Нитрование). При этом в зависимости от условий нитрования в бензольное ядро м. б. введено несколько нитрогрупп,-обыч-но не более 3, в исключительных случаях 4. Различают первичные (I), вторичные (П) и третичные (1П) Н. в зависимости от числа 1 ... 26 27 28 29 30 31 32 ... 48 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© 2007 SALROS.RU
ПромСтройМат |