 |
 |
 |
 |
1 2 3 4 5 6 7 ... 49 М ш т РаШор Г внутренние напряжения в металле, деформация металла (фиг. 1, В; пара: М недефор-мир.-М деформир.)]; 4) различные части металла находятся в неодинаковых физико-химическ. условиях, напр. в разных растворах. Особенно важным случаем такого рода концентрационных пар являются гальванич. пары [фиг. 1, Г; пары: а) М в растворе богатом О2-М в растворе бедном Oal б) М в воде-М в иле; в) М в иле-М в песке], образующиеся вследствие неодинакового притока кислорода к разным частям металла (диференциальная аэрация). В большинстве случаев коррозии различные типы гальванических пар имеют место одновременно. Разность потенциалов данной гальванической пары зависит от многих условий и в первую очередь от вещества электродов. Для Иапровление движения СраВНбНИЯ МвТаЛЛОВ ПО ИХ wCTino M (£jw/7wiP5 w..(3noco6iiocTH переходить в раствор и вытеснять водород их располагают в таблицу т. наз. стандартных, или нормальных, потенци-катсд алов. Однако необходимо ,М'+е н'+е-Н заметить, что значения стандартных потенциалов получаются при строго определенных условиях, а именно, когда металл находится в электрохимическом равновесии с нормальным раствором, содержащ. ионы того же металла. Если изменять концентрацию раствора или брать другой электролит, то потенциалы металлов будут меняться, причем может измениться и порядок их расположения, т. е. произойти перестройка таблицы. Поляризация и перенапряжение водорода на катоде также оказывают большое вдияние на разность потенциалов и на изменение эдс пары во времени. Поляризация зависит как от природы пары (вещества электродов), так и от свойств электролита. Уравнения I и II (а и б) показывают, что процесс коррозии слагается из двух связанных друг с другом процессов: 1) перехода ионов металла в раствор, с одновременным выделением водорода на катоде (поляризация), и 2) удаления образующейся на катоде пленки водорода (деполяризация). Можно считать, что первый процесс протекает со значительно большей скоростью, чем второй; поэтому общая скорость К. оп1)еделяется скоростью деполяризации. В тех же случаях, где деполяризатором является кислород воздуха (напр. при ржавлении железа), скорость деполяризации в свою очередь зависит от скорости притока кислорода; последняя и будет определять суммарную скорость К.; таким образом первая часть теории К. есть в сущности применение теории электрохимического элемента к процессам химического разрушения металлов. 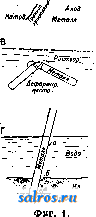 Второй частью учения о К. является теория т. наз. поверхностных защитных п л е н о к. В процессе К., в результате вторичных реакций (особенно при участии растворенного кислорода воздуха), на металле могут образовываться пленки, к-рые, во-первых, затрудняют контакт меладу металлом и средой, а во-вторых, увеличивают внутреннее сопротивление электрических пар, что ведет к замедлению или даже полному прекращению К. Простейшими примерами защитных пленок являются например пленки PbSOi, образующиеся на свинце при растворении последнего в ИлЗОд, пленка AUOg, покрывающая алюминий на воздухе, и т. д. Толщина защитной пленки колеблется от размеров молекулярного порядка до видимых невооруженным глазом. Весьма вероятно, что пленки очень малой толщины построены совершенно особым образом и в основе образования их лежат явления адсорбции (см.). С возникновением таких пленок (могущих в частности быть образованными и из молекул газов) связаны явления пассивности металлов, тоже играющие большую (положительную) роль в процессах К. И эленстрохимич. сторона явлений К. и образование защитных пленок зависят как от природы и состояния самого металла (внутренние факторы), так и от природы и состояния коррозионной среды (внешние факторы), а потому изучение К. требует полного рассмотрения всей системы металл-среда (электролит). Влияние состава и структуры металла. Химич. состав дает только самое общее представление о физико-химич. природе металла. Поэтому при рассмотрении химической устойчивости металла или сплава необходимо обращаться к данным их металлограф, изучения. Химически чистые металлы тоже в большинстве случаев оказываются не вполне однородными (примеси, включения, поликристалличность); однако данные, полученные для наиболее чистых образцов мета-тла, можно в первом приближении относить к свойствам атомной решетки химически индивидуального металла. В табл. 1 приведены наиболее важные данные о химич. устойчивости чистых металлов. Сложные системы, образованные несколькими составляющими, при прочих равных условиях будут обладать наименьшей устойчивостью, т. к. здесь имеется большая возможность образования микропар. Поэтому при получении химически устойчивых сплавов необходимо стремиться получить: а) возможно более полную структурную однородность сплава, б) максимальную устойчивость его составляющих, в) прочные и легко восстанавливающиеся защитные пленки. Эти условия до-ститаются таким подбором состава сплава и такой термическ. и механическ. обработкой, чтобы получались однородные твердые растворы и чтобы состав последних обеспечивал химич. стойкость металла надлежащим внутренним строением или образованием защитных пленок. В ряде случаев твердые растворы обладают также относительно высокими механич. качествами. Внутренние напряжения и деформации металла вообще уменьшают его химич. стойкость. При этом коррозии Табл. 1 .-X имическая устойчивость чистых металлов. Стандартный потенциал по т^т^ отнош. к На j чНС1 I НКОз -1,4 -0,4
СНо Нсйтр. раство- H2SO4 I .СООН ! NaOH I солей Влажный воздух разные реагенты 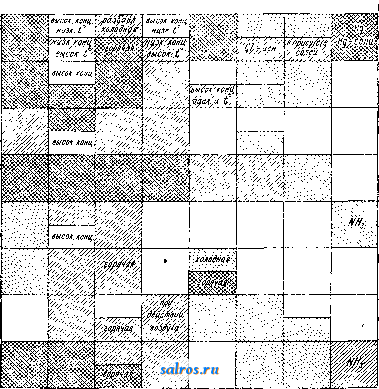 Не действует-  Действует Медленно действует  Быстро разрушает особенно часто проявляется крайне опасный вид К. - т. н. интеркристаллитная (или интеркристаллическая) К., когда разрушение происходит по границам зерен-кристаллитов металла и, несмотря на внешне благополучный вид материала, механич. свойства его м. б. уменьшены во много раз. Состояние поверхности металла тоже является одним из важнейших внутренних факторов К. Влияние механич. обработки, пред-ставляюшей особый вид поверхностной деформации материала, сказывается различно для разных металлов и разных внешних условий. Для железн. металлов тонкая механическая обработка поверхности (например полировка) дает увеличение химич. стойкости. Химич. обработка поверхности металла может приводить: а) к образованию на металле слоя соединений, к-рые в нек-рых случаях играют роль защитных пленок (пассивирование поверхности); б) к удалению ранее образовавшегося на металле поверхностного слоя (активирование поверхности), что обычно ведет к уменьшению химическ. устойчивости; в) к возрастанию содерисания включений благодаря растворению менее благородной составляющей, что ведет к увеличению числа микропар и следовательно тоже к усилению К. Влияние внешних условий. А. Температура. С повышением t° происходит увеличение скорости химич. реакций; кроме того увеличивается скорость диффузии и усиливаются конвекционные токи, что способствует притеканию к металлу свежих порций электролита. Келкот и Уэтзел предлагают при учете влияния t° пользоваться ф-лой для гетерогенных реакций: In Д = -Ь I, где R-константа скорости К. (меняющаяся с <°),J. и В-постоянные, Т-абсолютная темп-ра. Во многих случаях общий характер кривых (скорость К.-темп-ра) соответствует приведенной ф-ле. Однако при повышении t° растворимость кислорода в воде па- дает, и поэтому в тех случаях, где кислород играет роль деполяризатора, выше известного Г-ного предела наступает уменьшение скорости К., так как ни увеличение активности системы ни ускорение диффузии и конвекции не смогут компенсировать недостаток кислорода в растворе. Из диаграммы (фиг. 2; символ И обозначает среднюю 0,075 OfiSO 0,025
го 40 60 80 100 Фиг. 2. 120 МО 160 180 убыль ТОЛЩИНЫ металла, служащую мерою скорости К.) видно, что при постоянном со-дернсании кислорода в растворе (замкнутая система) наблюдается непрерывное увеличение скорости К. с Г (железо в воде); в случае же открытой системы (кислород может удаляться при нагревании) кривая имеет максимум, за которым следует уменьшение скорости К. Движение электролита относительно металла как правило увеличивает скорость К.; однако и здесь иногда (напр. для железа) наблюдаются максимумы на соответствующей кривой. Б, Природа раствора. Наиболее общей характеристикой раствора является концентрация водородных ионов Рц. На фиг, 3 0,020 0,015 0,010 0,005
Фиг. 3. представлена кривая, изображающая зависимость скорости К. железа от Рд раствора. Можно отчетливо разделить диаграмму на три области: 1) Рн> 10 (щелочная область)- К. идет медленно и скорость ее зависит от PhJ 2) Рн = 4,34-10 (нейтральная область)- скорость К. почти не зависит от Рн; 3) Рн < 4,3 (кислотная область)-скорость К. резко увеличивается и зависит от Р^,. В первых  Фиг. 4. двух областях К. идет за счет деполяризации кислородом воздуха, растворенным в жидкости; в последней, кислотной, области водород выделяется в виде пузырьков (хотя часть его вероятно тоже окисляется кислородом). Для алюминия примерный вид диаграммы изобралсен на фиг. 4; .здесь зависимость скорости К. от Рд для щелочной зоны обратна только что разобранному случаю (с возрастанием Рн скорость толсе возрастает). Природа ионов в растворе также играет чрезвычайно . большую роль. Последнее связано как со специфичностью взаимодействия данного рода ионов и металла, так и со вторичными реакциями (образование пленок). В солян. растворах на характер и скорость коррозии влияют оба иона соли. При растворении солей электропроводность жидкой фазы увеличивается и возникают конвекционные токи, что должно сказаться на ускорении К.; с другой стороны, нонюкение растворимости кислорода будет замедлять К. Поэтому на кривой (скорость коррозии - концентрация соли) могут наблюдаться максимумы и минимумы в соответствии с тем, какие стороны влияния концентрации превалируют. В соляных растворах особенно опасным является С1-И0Н, так как он в большинстве случаев сильно активирует поверхность металла; химический состав раствора также может влиять на протекание вторичных реакций и следовательно на образование защитных пленок. Характерным примером является действие хромовых солей на железо. В их присутствии железо быстро пассивируется и скорость К. резко падает. Окис-литейи в растворе действуют двояко: с одной стороны, они усиливают деполяризацию и следовательно способствуют развитию коррозионных процессов; с другой стороны, окислители часто действуют пассивирующим образом (напр. крепкая азотная к-та на железой алюминий). Газы в растворе являются тоже одним из важнейших факторов: напр. кислород, за счет к-рого могут итти процессы деполяризации, или СО2, участвующий во многих вторичных реакциях. Даже в случаях действия к-т деполяризация кислородом оказывается первостепенным фактором, на что указывают напр. случаи растворения меди в к-тах. Иллюстрацией такого влияния кислорода молсет служить фиг. 5, где показана зависимость между скоростью К. меди в различных к-тах и составом газовой фазы над раствором. Образованию местных пар иногда способствует действие света, что отмечено например при К. некоторых медных сплавов. Классификация явлений К. Есть несколько способов классификации явлений К. I. Классификация по характеру деполяризации: 1) водород выделяется в виде пузырьков (К. в сильно кислой среде, К. алюминия и магния в щелочах); 2) водород окисляется кислородом воздуха, растворенным в электролите (К. в слабо и умеренно кислой или в слабо щелочной среде,-напр. в растворах гидролизующихся солей); 3) водород частью окисляется кислородом воздуха, частью же выделяется в виде пузырьков (разбавленные к-ты, недостаток окислителя). П. Классификация по характеру разрущений. 1) Обычный сплощ-ной тип разрущений; К. распространяется б. или м. равномерно как по телу, так и по границам кристаллитов (напр. обычные случаи К. железа на воздухе и в воде); здесь можно выделить две подгруппы: а) равномерная К.-разрушение равномерно распределено по всей площади металла (вкл. л., 1); б) местная, или локализованная, К.-разрушения сконцентрированы на ограниченной площади (вкл. л., 2); различают также например точечную, или перфорирующую, К.-сильные разрушения в определенных 0.Ш 0,200 0,160 0,120 opso 0,040
4 8 /2 ;б го 24 % кислорода в атмосфере над кислотой Фиг. 5. точках поверхности (вкл. л., 5 и 4), полосчатую-К. распространяется полосами по определенным направлениям, и т. д. 2) Интер-кристаллитный тип К.-разрушения идут гл. обр. по границам кристаллитов (вкл. л., 5). Сюда относятся многочисленные случаи К. легких алюминиевых сплавов, железа в щелочах, латуни в морской воде. Возможна также классификация типов К. по характеру образующейся электрохимич. пары (макропары, микропары, концентрационные пары) и по нек-рым иным признакам. Количественное выражение К. К. может быть выражена количественно самыми различными способами в зависимости от того, изменение какого свойства металла при К. измеряется. В технике наиболее употребительны три способа выражения К. а) Потеря в весе за определенное время (в зависимости от скорости К.) с единицы поверхности металла: напр. г1см в день, г/лг в год и т. д. Выбор единиц измерения зависит от скорости процесса. Потерю в весе от К. принято обозначать символом К. б) Средняя убыль толщины металла за определенное время; выражается в слг в день или см в год рши дм. (англ.) в год. Зная уд. в. металла, можно перевести потерю в весе на убыль толщины и обратно. Средняя убыль толщины как выражение К. удобна тем, что она сразу дает вещественное представление о размерах К. в) Потери механич. качеств (гл. обр. коэф-та крепости г„,вд. в кг/мм и относительного удлинения г в %), выражаемые в % от качества исходного материала. Способы защиты металлов от К. Металлы предохраняются от К. тремя способами: покрытиями, электрохимич. защитой и обработкой коррозионной среды. А.Покрытия.1) Краски, лаки и смолы. Основным условием применения такого рода покрытий помимо специальных качеств (кроющая способность, непроницаемость, схватываемость, прочность и т. д.) является требование химич. инертности по отношению к защищаемому материалу. Для защиты железных материалов широко применяются масляные и эмалевые краски, асфальтовые лаки; для легких алюминиевых сплавов наилучшими против К. от атмосферных влияний считаются лаки типа Дюраль ; против коррозии в морской и пресной воде- битуминозные лаки типа Инертоль (итал.) или Кузбас (рус). 2) Металлическ. покрытия по способу их получения разделяются на следующие: а) электрохимические (сюда же относятся га.т1ьваническ. покрытия), осаждаемые на металле из раствора с применением или без применения электрич. тока (напр. покрытие железа медью, оцинкова-ние); б) горячие, получаемые на металле путем погружения его в расплавленный металл (напр. горячее оцинкование); в) диффузионные-защищающий металл (обычно в виде порЪшка) заставляют при высокой t° диффундировать в защищаемый (напр. горячее хромирование); г) диффузионно-механические-защищающий металл при высокой t° впрессовывается в защшцаемый при помощи прокатки. Здесь силам диффузии помогают силы механич, порядка (например покрытие стальных листов разнообразными сплавами) ;д) шоопирование-набрызгивание металла при помощи пульверизации на защищаемый металл. По характеру защиты все металлические покрытия можно разделить на две группы: анодные и катодные покрытия, в зависимости от того, электроотрицательно или электроположительно покрытие по отношению к защищаемому металлу. Анодные покрытия защищают металл не только благодаря изоляции его от внешней среды, но и благодаря тому, что в образующейся паре покрытие является анодом и следовательно при действии электролита будет само разрушаться, в то же время защищая металл. Случайные царапины, обнажения и т. п. не будут опасны в этом случае, т. к. соседние участки покрытия будут защищать металл электрохимически (пример- защита железа цинком). Катодные покрытия защищают металл только при условии сохранения сплошной пленки. Обнажения металла могут повести наоборот к быстрой К., так какздесь защитный металл будет играть роль катода и следовательно помогать К, (пример-никелированые железные изделия в растворах солей). Из катодных покрытий для железа особенное распространение получает за последнее время хромирование (см. Хром). В качестве анодных покрытий для легких алюминие- 
Сталь вых сплавов предложен цинк (СССР) и кадмий (Германия). Эти способы защиты разрабатываются в ЦАГИ. Катодные покрытия для легких сплавов, предложенные французами (покрытие медью и хромом), не оправдали себя. 3) Керамические покрытия применяются в химич. промышленности. Широко также распространено эмалирование для защиты железа. Особые защитные пленки, обычно окисного характера, получаются при обработке защищаемого металла различными химич. реагентами под током или без тока. Для защиты легких алюминиевых сплавов известны способы Бау-ера (обработка углекислыми солями) и Ирот-ка (обработка сложными солями под током); удовлетворительные ре--J зультаты дает также и анодная поляризация. Железо защищают например при помощи воронения (см.), нагревая при высоких t° (горячий способ) или обрабатывая различными электролитами (холодный способ). Магниевые сплавы покрываются защитной пленкой при погружении их в растворы хромистых солей. Б. Электрохимическая защита. Деви еще в 1825 г. предложил защищать латунные и медные листы от действия морской воды щтем прикрепления к ним цинка. В настойщее время подобный способ применяется в морском деле для защиты например корабельных винтов. Вблизи винта (фиг. 6) ставится массивный цинковый, протектор, который и играет роль отрицательного электрода пары [латунь или бронза (винт)- цинк (протектор)]. Цинк постепенно разрушается и заменяется новым, а винт остается целым. Аналогично с этим ЦАГИ в последнее время разработал способ защиты от Фиг. 6. 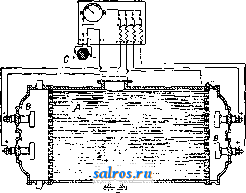 Фиг. 7. коррозии легких алюминиевых сплавов, комбинируя катодные покрытия с применением цинковых протекторов. Несколько иным способом защищают конденсационные устройства и стенки паровых котлов (фиг. 7). Добавочный электрод В (напр. железный) соединяют с положительным полюсом батареи или динамомашины постоянного тока С, а защищаемый предмет (конденсационные трубки Л)-с отрицательным полюсом той же батареи. Добавочный электрод будет постепенно разрушаться и переходить в раствор (воду), а защищаемый металл останется целым. В. Обработка коррозионной среды. Можно наконец видоизменить коррозионную среду т. о., чтобы ее разрушающие свойства уменьшились. Такого рода методы применяются в сравнительно редких случаях: например при защите паровых котлов соответствующими операциями удаляют кислород из питающей воды. Материалы и реагенты. Металлы и сплавы не в одинаковой степени подвергаются воздействию различных реагентов. Железо и железные сплавы. В воде и растворах солей К. железа происходит за счет деполяризации кислородом воздуха, растворенного в жидкой среде. Как показали многочисленные исследования (Эй-чисон, Чеппел, Гадфильд, American Society for Testing Materials, National Tube Co. и др.), состав металла в границах обычных сортов железных материалов, по сравнению с иными факторами, не оказывает существенного влияния на ход коррозии. Неблагоприятное действие оказывает повидимому повышенное содержание S, Р, Si и Мп. Добавка меди в пределах 0,2-1,5% улучшает антикоррозионные качества металла, особенно при воздушной К. Наиболее опасно в коррозионном отношении присутствие в растворе солей ти-*па КС1, K2SO4 и NaNOg, а также присутствие С1-И0Н0В в связи с любым катионом. Соли типа K4Fe(CN)e, Ыа.2СОз, как дающие нерастворимые пленки, при некоторых концентрациях могут оказывать даже защитное действие. Хромовые соли определенно защи-. щают металл. Аэрация и движение раствора являются одними из главнейших факторов усиления К. Ш;елочные растворы низкой концентрации в большинстве случаев не опасны, в особенности если они также содержат углекислые соли. При высокой концентрации щелочи, а также при высокой t° и давлении наблюдается сильная интеркри-сталлитная К. На микроснимках (вкл. л., б и 7) видна целая сеть микроскопич. трещинок по границам кристаллитов. Эти трещинки, сливаясь, дают уже видимые внутренние и поверхностные трещины. Интеркристал-литной К. в этих условиях способствуют: а) повышенное содержание S, б) окислы (недостаточное раскисление металла при плавке или перенсог при последующей обработке), в) внутренние напряжения (возникающие напр. при сгибании листов, при холодной клепке и т. п.). Ш;елочам хорошо сопротивляется мягкая сталь с содержанием 3-5 % Ni. В к-тах К. идет как с выделением свободного водорода, так и с окислением водорода кислородом воздуха или самой к-той, если последняя является окислителем (напр. HNO3, крепкая HgSOJ. Обычные железные материалы вообще не рекомендуется употреблять в качестве оболочек при сильных реагентах, какими являются к-ты; здесь надо переходить к более сложным сплавам, за исключением нек-рых отдельных случаев. Так, для азотной к-ты крепостью выше 40 % КОРРОЗИЯ  в г д е ж      1. Коррозия металлов и сплавов железной группы в 10 HCI по истечении 10 дней -химически чистое железо; б -химич. чистый никель; - сплав (4б ,(, Ni, 54 Fe); -(25 ,1 Cr, 75 , Fe); д- (18° Cr, 120,0 Co, 300 Fe); c -(15 o Cr, 63 Ni, 21 -о Fe, IS Мп);ж--(15,о Cr, 62% Ni, 15% Fe, 1% Mn, 7%Mo). 2. Образец отожженной нержавеюи1ей стали, начав1лпй корродировать после 10-дневного пребывания в морской воде. 3. Корродирующий участок тонкого дуралюмннового листа, пораженного точечной коррозией. 4. Поперечное сечение дуралюмннового листа; граница разрушения совпадает с границе!! кристаллита а. 5. Сильная интеркристаллитная коррозия дуралюмина. Образец вырезан из трубы, корродировавшей во влажном морском воздухе при неблагоприятных условиях (контакт с латунью, возможность застаивания воды). 6. Интеркристаллитная коррозия. Образец вырезан из стенки парового котла. 7. Интеркристаллитная коррозия. Образец вырезан из железного бака с каустической содой. 8, Коррозия клепаной луралюминовой пластинки после 10-дневного пребывания н морской воде. Сильная коррозия, особенно у заклепок. можно употреблять обычное железо или же (;таль. При производстве азотной кислоты, а также при работе с конц. серной кислотой (70-100%-ной) часто употребляют чугуны. В качестве типичных образцов приводится состав двух англ. отливок, с успехом работавших в заводских условиях. С с Угун общ. связ. А . . . . 3,3 Б . . . . 2,75 0,65 0.6 0,45 1,8 1,5 1,0 0,2 0,35 0,35 В чугуиах необходимо избегать слишком высокого содержания Si; связанного углерода д. б. не менее 0,6-0,8%. Весьма вредным оказывается Р, особенно если он реагирует с образованием мест фосфористой эвтектики. При работе с НС1 любых концентраций железные материалы совершенно неприменимы. Дымящая H2SO4 вызывает сильную ин-теркристаллитную К. При работе с HNOg и H2SO4, а также с различными растворами солей и органич. веществами можно рекомендовать применение листов очень чистого железа, например америк. Агтсо (см. Арм-ко-01селезо)\ последнее обладает значительно более высокой химической устойчивостью по сравнению с обычными железными материалами. Железо-кремнистые сплавы (высококремнистое литье) содержат обычно 13- 18% Si, хорошо сопротивляются действию к-т H2SO4, HNO3 и даже НС1 (в невысоких концентрациях). В этих сплавах содержание углерода м. б. до 0,7%; S и Р должно быть возможно меньше; Si не должен получаться в т. н. графитной форме. Эти сплавы можно с успехом применять также при работе с органич. к-тами-уксусной, лимонной и т. д. Изделия из этих сплавов получаются только отливкой; механич. качества их несколько ниже, чем у обычных чугунов. Наиболее известны марки Тгопас (Англия), Duriron (Америка), Termisilid (Германия, Крупп). Железо-хромистые сплавы образуют класс т. н. нержавеющих сталей. Различают: нержавеющее железо (0,1 0,15% С; 12-f-15% Сг) и нержавеющую сталь (0,3-f-0,4% С; 12-М5% Сг). Первое обладает несколько более низкими механическими качествами, но зато легче обрабатывается и не нуждается в термич. обработке. Хим. устойчивость нержавеющей стали в большой степени зависит от ее термич. обработки. Необходима закалка 850-900° на воздухе или в масле, с отпуском 500-600°. У отожженной стали антикоррозионные качества понижаются в несколько раз. Применение нержавеющих сталей видно из табл. 2, где сопоставлены стали: углеродистая, нержавеющая и сталь марки V2A. Добавка к стали небольшого процента меди повидимому полезна. Марганец понижает антикоррозионные качества и его присутствия необходимо избегать при изготовлении этой стали. Весьма вредны таклсе включения окислов. Нержавеющие стали в термически обработан, виде и нержавеющее н:елезо могут применяться при работах с водными растворами солей (морская вода, рудничные воды) и с растворами к-т невысоких концентраций (за исключением НС1); эти стали в настоящее время начинают применяться д.т1я изготовления ножей, хирургических инструментов и т. и. Желез о-н и к е л ь-х р о м и с т ы е с и лав ы обладают еще более высокими антикоррозионными свойствами, чем железо-хромистые. Наиболее известны следующие марки: Марка С,% Сг,% Ni.% V2A (Крупп)....... 0,25 20 7 Аиска (Англия)...... 0,10 15 10-12 Staibrit (Америка) .... 0,2-0,4 18 8 Хромоникелевые стали обладают высокими механич. качествами, хорошо куются и прокатываются, не требуют термич. обработки, хорошо сопротивляются самым разнообразным химическ. реагентам. В последнее время в Германии из стали V2A приготовляют листы, трубы, части насосов, хирургические инструменты, вечные перья и т. д. Сплавы с высоким содерлсанием Ni дают наилучшие результаты, хотя сравнительно дороги. Сплав состава 63%Ni, 15%Ре, 15%Сг, 7%Мо хорошо сопротивляется 10%-ной HCI. Против H2SO4 хорошие результаты дал сплав 50%Ni, 50%Fe; против H2SO4, HNOsHHCI- сплав 63% Ni, 21% Fe, 15% Сг. Медь и медные сплавы. Вода и водные растворы солей заметно действуют на медь при свободном доступе воздуха. Усиливает К. присутствие в растворе HgS, QO-i и особенноNH3. Медь склонна образовывать местные концентрационные пары. Химическая устойчивость меди сильно пони-лгается при повышенном содержании окислов в металле. В кислотах, даже в слабых растворах их, медь сильно корродирует. Бронзы (Cu-Sn) употребляются при сравнительно слабых коррозионных агентах (загрязненный воздух, слабые растворы солей). Бронзы, представляющие однородный твердый раствор, обладают более высокой химич. устойчивостью, нежели бронзы структурно сложные. РЬ повидимому ухудшает антикоррозионные качества бронз. Кислые сточные воды действуют на бронзу в 20 раз слабее, чем на железо; бронзовая проволока в загрязненном воздухе химич. фабрик корродирует в 2-4 раза меньше, чем железная. Против HjsSO* удовлетворительные результаты дает цинковая бронза Хубертца. Против разбавленных кислот рекомендуется кобальтовая бронза. Хорошие качества показала хромакс-бронза, т. е. марганцевая бронза, в к-рой часть Мп заменена Сг. По-видимому наиболее химически устойчивой в соляных растворах и слабых кислотах является алюминиевая бронза-95%Си, 5% А1 или90%Си, 9%А1, l%Ni. Л ат у н и (Cu-Zn) довольно широко применяются в морском деле. Сплавы, которые содержат однородные а-кристаллы, обладают наивысшей химической устойчивостью. В латунях с высоким содержанием Zn происходит быстрое выщелачивание Zn (децинцификация) в морской воде. Прибавка 15% Ni увеличивает стойкость таких сплавов. Латуни, обладающие крупнокристаллич. структурой, корродируют быстрее, нежели мелкокристаллические. Повышение t° отжига ведет к увеличению К.; так же действует и закалка. Вредное в.чияние оказывают наклеп и внутренние напряжения: они вызывают сильную интеркриста.тлитную К. В морском деле Табл. 2.-С р а в н и т е л ь н о е действие различных реагентов на углеродистую высокохромистую и высокохромоникелевую сталь. Реагент Уксусная к-та То те (пары) . Бензойная к-та Борная к-та . . Карбо.човая к-та Хлоруксусн. Хлорсульфон. к-та Лимонная к-та . . Синильная к-та . . Соляная к-та . . . Фтористоводородная к-та........ Молочная к-та. . . Малоновая ... Смесь HNO.+ HjSO. . Азотная к-та .... Щавелевая к-та . . . . Фосфорная . . Пикриновая к-та . Пирогаллол .... Стеариновая к-та . Серная к-та .... Сернистая к-та . . Таннин ...... Уксусный ангидрид ....... Ацетон...... Алюминий сернокислый ....... Алюминий сернокислый ........ Аммоний бромистый углекислый х^юристый Аммиак....... Аммоний азотнокислый........ Аммоний сернокислый ........ Аммоний сернокислый ........ Пиво......... Бензол ....... Бром......... Бромная вода . . . . ....! Камфора......j Концентрация и f oj >-НО Ход о к Д о Ш% 33% 15% 5% Все концентр. Насыщ. раствор 5% 10% холодн. ) горяч. f Все концентр. Кристаллич. 50% Концентр. Все концентр. Все t° и концентрации 50% при 100° 5% при 15° и 100 Уд. в. 1,42 1,20 Ниже 11% 1-10% при 15-100 5-50% при 15-100° 5-100% Все конпентр. 100% 100% 5% 1-5% при 15-50° Насыщенный 20% 1% 47%, КИПЯЩИЙ Все концентр. 100% 3,3% 0.15% о Реагент Сероуглерод . . . . Углерод четыреххло- ристый....... Хлор ........ Медь углекислая . . хлорная.... сернокислая . Спирт винный . . . Эфир этиловый . . . Железо хлорное . . азотнокис- лое ........ Формальдегид . . Сок фруктовый . . Водорода перекись Чернила...... Иод......... Известь гашеная . . Масла смазочные . . Магний хлористый . j сернокислый j Ртуть азотнокислая хлорная . . цианистая. Молоко...... Никель азотнокислый ........ Нефть ........ Калий бромистый цианистый железосине-родистый ..... Калий азотнокислый ........ Калий щавелевокислый ....... Морская вода . . . Серебро азотнокислое ........ Натрий бромистый . хлористый. лимоннокислый ........ Натр едкий..... ..... Натрия гипохлорит Натрий азотнокислый ........ Натрия перекись . . Натрий кремнекислый ........ Натрий сернокислый ........ Натрия тиосульфат Натрий сернистый . Концентрация и t us В И о 1-50% Насыщ. раств. в NHiOH 5-10% + 2% H.SO. 100% 100% 10-50% 5% 40% Н асыщен. рас твор в KJ Суспензия 10% 10% 5% 0,5-5% 5% I Свежее или кис- 1 лое 5-10% 1-10% при 15-50 5% насыщ. раств. 0,25-1% 15° 80° В ПОСТ, движении Периодич. Обрызгивание 1-5% 5-10% 3-10% 3-5% 66% 33% 0,2-5% 5% 10-80° 5% насыщ. 10% насыщ. 30% 10% ф - практически не действует на металл; <> - действует: быстро разрушает. ез о О получили также распространение специальные бронзы: мунц-металл, кремнистая латунь, марганцевая бронза (закалка повышает антикоррозионные качества этого металла), Дюрана металл, марганцевая бронза Парсона (см. Спр. ТЭ, т. II). Против слабых кислот рекомендуется бронза Парсона и сплав: до 62% Си, 35-43% Zn, 0,2- 1,5% Si, 0,5-0,65% Sn. Латуни с высоким содержанием Ni (нейзИльберы) в отношении антикоррозион. качеств превосходят обычные сорта латуней. Употребительны составы: 1) 60-50%Си, 15-40%Zn, 12-25%Ni, 2) 7-20% Си, 40-50% Zn, 35-40% Ni. Медноникелевые сплавы. Из этого рода сплавов наиболее распространен монель-металл, обладающий наряду с высокими механическ. качествами хорошей сопротивляемостью действию кислот, соляных растворов, загрязненного воздуха, рудничных и сточных вод и щелочей. Азотной к-те хорошо сопротивляется сплав Парра. Для к-т рекомендуются также сплавы Ирмана. В самое последнее время предложены также медно-кремне-кобальтовые сплавы (4% Si, 4-8% Со, остальное Си), которые наряду с высокими механич. качествами оказывают хорошее сопротивление сравнительно сильным коррозионным агентам. Свинец и свинцовые сплавы. Вода действует на свинец различно, в зависимости от того, какие соли в ней растворены. Жесткая вода не действует на свинец, тогда как мягкая довольно быстро разрушает последний. Присутствие в растворе хлоридов и нитратов усиливает коррозию; сульфаты же, напротив, действуют защищающим образом (образование пленки PbSO 4). Щелочные растворы также заметно действуют на свинец; по этой причине свинцовые трубы не должны прокладываться в цементе и вообще соприкасаться с материалами, содержащими известь и другие щелочи. Характер К. свинца в большинстве случаев ин-теркристаллитный. Лучше всего свинец противостоит действию H2SO4; только при концентрациях H2SO4 свыше 80% начинает обнаруживаться заметная К. Чистота металла играет большую роль. Так как чистый свинец обладает весьма низкими механич. качествами, в хим. промышленности получили распространение Pb-Sb сплавы (до 12% Sb), прочность которых уже значительно выше, чем чистого свинца; присутствие в этих сплавах As и Zn сильно уменьшает их антикоррозионные свойства. Свинец также удовлетворительно сопротивляется действию смешанной кислоты, если только содержание воды в ней не превосходит 25%. Алюминий и легкие алюминиевые сплавы. В нейтральных соляных растворах, в особенности в присутствии С1-нона, А1 и ,А1-сплавы подвергаются сильной интеркристаллитн. коррозии (вкл. л., 5 и 8). Сплавы алюминия даже при низком содержании примесей оказываются значительно менее устойчивыми к К., чем совершенно чистый алюминий. Особенно вредно действуют структурно-свободные FeAlg и Si. Термическая обработка играет поэтому весьма большую роль;в большинстве случаев закалка, сопровождаемая переводом составляющих в твердый раствор, увеличивает химич. устойчивость металла. Включения CuAlg играют роль добавочных катодов; однако переход значительных количеств меди в твердый раствор повидимому сильно уменьшает коррозию. Внутренние напряжения и деформации увеличивают К. Движение жидкости относительно металла, как показывают последние исследования ЦАГИ,.тоже усиливают К. Контакты с Си, Ni, латунью, нержавеющей сталью действуют на металл весьма неблагоприятно, и их необходимо тщательно избегать в конструкциях. Контакты с железом и сталью почти не влияют на К. алюминия; цинк в контакте с алюминием и дуралюмином защищает последние. Относительно влияния контакта с другими металлами пока еще нет достаточных данных. Щелочные растворы быстро разрушают алюминий и алюминиевые сплавы, и потому при работе с ними применение А1 совершенно недопустимо. Кислоты тоже действуют разрушающе, за исключением азотной и уксусной кислот высокой концентрации. В последнее время в Германии напр. получили распространение алюминиевые баки для перевозки крепкой азотной к-ты. Легкие сплавы с высокой сопротивляемостью К. пока еще не выработаны, хотя в нек-рых странах и предложены б. или м. удачные составы . Из последних мол:но упомянуть только германск. сплав KS Seewasser (2,5% Мп, 2,25% Mg, 0,2% Sb, остальное А1); сплав обладает повышенной стойкостью по отношению к морской воде. Довольно широкое применение начинает получать чистый алюминий в пищевой, жировой и красочной промышленности как материал для химич. аппаратостроения. Методы испытания металлов и сплавов на К. Методика испытания на коррозию представляет чрезвычайно важную проблему, так как при большом числе действующих факторов надежные результаты можно получить только при правильной постановке экспериментов. Ниже приведена схема методики испытаний с указанием, какие условия (внутренние и внешние) необходимо принимать во внимание, а также какими показателями можно пользоваться. В большинстве случаев однако нельзя слишком усложнять эксперименты и лучше пользоваться системой отдельных экспериментов, данные которых будут взаимно дополнять друг друга. Наиболее важные методы следующие. 1) Испытание в открытых сосудах: образец погружен в данную жидкость; производят внешние наблюдения, определяют потери в весе и иногда производят механическ . испытания. 2) Испытание в шпиндельном аппарате: жидкость находится в движении относительно образца (вращение образца или перемешивание жидкости), и одновременно производится аэрация жидкости; наблюдения те же. 3) Попеременная К.: образцы укрепляются в зажимах медленно движущегося колеса, так что образец то погружается в раствор то находится в воздухе. 4) Электрохимические методы: приборы в большинстве случаев представляют по-тенциометрические установки, причем возможно таклсе одновременное измерение силы тока. На фиг. 8 изобралсена схема установки, разработанная в лабораториях ЦАГИ. 5) Определение скорости К. по количеству выделяющегося газа-применимо главн. обр. при К. в к-тах. 6) Определение скорости К. по тепловому эффекту реакции-пока еще мало )азработано. 7) Исследование процесса К. под микроскопом: один из новых методов, дающий чрезвычайно много ценного для уяснения деталей и механизма коррозионных процессов (разработан в ЦАГИ). 8) Макро-стереоскопическ. наблюдение прокорродиро-вавших образцов-дает хорошие результаты при выяснении характера и распределения продуктов К. и относительной глубины разрушения. 9) К. в подогреваемом шкафу Схема методики исследования коррозии металлов в электролитах.  1. Химический состав 2. Физико-химич. состояние 8. Поверхность A. Железная группа: а) обычн. железные материалы б) специальн. железные сплавы Б. Медная группа: а) обычн. медные сплавы б) специальн. медные сплавы B. Никелевая группа Г. Легкие сплавы (А1-, Mg-rpynna) Д. Остальные A. Литой Б. Механич. обработка: а) горячая б) холодная B. Термич. обработка Г. Напряженный металл Д. Деформированный металл A. Совершенно необработанная Б. Обработанная на станке B. Тонко обработанная (различной градации) Г. Травленая Д. Защитные покрытая: а) краска и лак (горячий способ б) металлы {электрохим. способ шоопирование в) керамика г) окислы и химич. соединения II. Условия коррозии  2. Движение образца относит, жидкости 3. Раствор 4. Форма А. Цилиндрики или брусочки Б. Плоские образцы в. Трубчатые образцы Г. Образцы для механических испытаний: а) из листов б) прутков в) литого материала г) вырезанные из деталей Д. Готовые детали Е. Клепаные пластинки 4. Окислители А. Регу-таруется Б. Не регулируется А. Покой Б. Движение: а) поток 0) круговое в) вихревое A. Дистил. вода Б. Пресная вода B. Морская вода: а) естеств. б) искусств. Г, Растворы солей Д. щелочей Е, кислот: а) окислит. б) не окислит. Ж. Органич. вещества важнейшие факторы: а) нормальность раствора б) концентрация Рн A. Воздух: а) без аэрации б) с аэрацией Б. Кислород: а) с аэрацией б) без аэрации B. COg: а) с аэрацией б) без аэрации Г. Негазообр, окислители: а) НгО, б) окислит, кислоты в) раствор желт, кровяной соли в щелочи г) перманганат д) бромная вода 5. Газовая среда над раствором A. Воздух Б, Кислород B. Нейтральные газы: а) N2 б) Нг Г. Другие: а) СОа в) 01 г) NHs О &3 1 2 3 4 5 6 7 ... 49 |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
© 2007 SALROS.RU
ПромСтройМат |