 |
 |
 |
 |
1 ... 28 29 30 31 32 33 34 ... 49 ризуется регулярным располол-сениом молекул, помещенных в вершинах так наз. пространственной ре HI е т к и, часть к-рой изображена на фиг. 1. Такая решетка получается при наличии трех взаимно пересекающихся систем плоскостей, причем в каждой системе плоскости параллельны друг другу и находятся на равных друг от друга расстояниях, неодинаковых в общем случае для трех систем плоскостей. Точки, в к-рых пересекаются плоскости, принадлежащие трем различным системам, называются узлами решетки (в них расположены молекулы). В общем случае все эти плоскости разделяют пространство на одинаковые клетки, которые имеют форму А Б -О О- 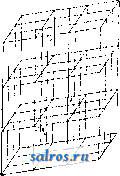 Фиг. 1.  ?! 4 4=7f 4Ш 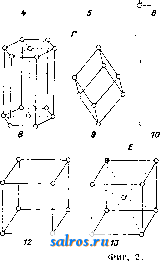
параллелепипедов. Простейший же случай: три системы плоскостей взаимно перпендикулярны и расстояния плоскостей друг от друга во всех трех системах одгшаковы (кубическая решетка). Теория пространственной решетки получила окончательное завершение в ряде работ Зонке, Шёнфлиса, Барлова и Федорова. Трудами названных ученых строго установлено, что в отношении правильного расположения молекул в пространстве имеют место 230 пространственных групп, которые в основном могут быть сведены к 14 пространственным решеткам (фиг. 2), из которых одна (фиг. 2, А) - т р и к л и и н а я, две (фиг. 2, Б)-м о н о к л и и и ы е, четыре-р о м-бические (фиг. 2, В), две-г е к с а г он а л ь и ы е, из которых одна ромбоэдрическая (фиг. 2, Г), две-т е т р а-гональные (фиг. 2, Д) и три-к у б и-ческие (фиг. 2, Е); среди кубических решеток следует отметить решетки простого куба (фиг. 2, Е, 12), центрированного куба (фиг. 2, Е, IS) и куба с центрированными гранями (фиг. 2, Е, Щ. См. Кристаллография. Теория кристаллич. решетки экспериментально подтвердилась в опытах с диффрак-цией рентгеновских лучей при их прохождении сквозь К. (Лауе, 1912 год). Если К. по этой теории состоит из частиц, расположенных по пространственной решетке на расстояниях, немногим более отличающихся от размеров атома, то рентгеновские лучи ( = 20-;-Vi4 А), пройдя через кристалл, дадут отчетливую картину диффракции в виде пятен, известным образом расположенных и отличающихся друг от друга своей интенсивностью. Дальнейшие исследования, в результате опытов Книппингена и Фридриха над пластинкой свинцового блеска, подтвердили результат, предполагавшийся теорией. Брагги (отец и сын), Терада и Вульф дали следующее толкование опытам Лауе: 1аждый из первичных пучков лучей, падающий на поверхность кристалла и разлагаемый им, можно рассматривать как отражение этого первичного пучка на одной из систем элементарных параллельных плоскостей, на которые можно разбить решетку К. Теория эффекта Лауе в общем сводится к следующему. Проходя; через кристалл, рентгеновский луч (той или иной Я) приводит в колебание электроны атомов, являющиеся структурными единицами К. Атомы при этом становятся источниками излучения, испуская волны с амплитудой, пропорциональной Z (атомному номеру). Волны, излучаемые всеми атомами решетки кристалла, интерферируют в окружающем К. пространстве, усиливая, ослабляя или даже уничтояая друг друга. Эти направления интерференции определяются ф-лой: 2d sin а = m Я, где d-расстояние друг от друга элементарных плоскостей (или, что то нее, узлов), Я- длина волны отраженного луча, а-угол падения луча на систему плоскостей, m-целое число (порядок отражения). Базируясь на методе рентгенографическ. исследований структуры К. галоидных щелочных металлов, Брагги нашли в частности, что атомы металла и галоида не собраны в явственные пары и в узлах решетки (как и предполагал Браве). По их исследованиям оказалось,  что в узлах решетки находятся составные части молекул (отдельные атомы или определенные группы атомов), отделенные в К. хлористого натрия (NaCl) равными промежутками (чередуясь в равных расстояниях на прямых, параллельных ребрам куба,- фиг. 3). Это дало повод утверждать, что К., не являясь собранием (в узлах решетки) молекул, а будучи собранием атомов, представляет собой как бы одну молекулу. Впоследствии Дебай доказал, что структурными единицами К.служат не нейтральные атомы, а ионы (и о н-ная решетка). На основе учения о строении атома (Бор), строении кристаллов хлористых щелочных металлов (Брагги), а также доказанной ионной природы структурн. единиц К. (Дебай), Борн вычислил теоретически размер решетки и механич. свойства К. Электрическая теория твердого тела дает следующие выражения для энергии кристаллической решетки гетерополярного (ионного) типа: где и-энергия элементарного кубика, а- постоянная величина, -расстояние между одноименными ионами. Число т находится из коэф-та V сжимаемости К. Фиг. 3. а(т- 1) Для решетки типа NaCl а = 13,94е^ и т = 9 (е-заряд электрона). В дальнейшем Дебай и Шерер, исходя из наблюдений, что рентгеновские лучи отражаются как от внешних граней К., так и от внутренних его плоскостей, усеянных атомами (причем для моно-хроматич. лучей это отражение происходит лишь под определенными углами), пропускали узкий пучок лучей через маленький столбик порошка из кристалла и фотографировали действие столбика на прошедший иучок на пленке, свернутой в цилиндр (на оси этого цилиндра помещался столбик по рошка). Оказалось, что получающиеся на пленке линии соответствуют пятнам лауе-граммы и что по этим линиям можно вывести структуру К. На основании изложенных методов была определена структура ряда веществ элементов и их соединений, причем этот способ позволил определить абсолютную величину междуатомных расстояний в кристалле (величину d в вышеприведенной ф-ле). Рентгенометрич. анализ строения К. приводит к следующим типам размещения атомов. Ббльшая часть химических элементов кристаллизуется в кубич. и гексагональной системе (с преобладанием наиболее плотного расположения атомов). В кубич. системе наиболее плотное расположение атомов осуществляется в виде решетки, параллелограмы которой имеют вид кубов с атомами в узлах и центрах граней. В гексагональной системе наиболее плотное расположение атомов получается при наслаивании перпендикулярно телесной диагонали куба. Кроме распололсения по ку- бу с центрированными гранями существует распололсение по центрированному кубу с атомами и в вершинах кубических ячеек и в центре этих ячеек. К вышеизложенному нужно добавить, что величина d (расстояние атомов друг от друга) в К. каменной соли, структура которой точно выяснена, выражается соотношением: d = 2,814 х\= Const. Ниже приводятся характеристики структуры некоторых элементов. 1. По куОу с центрированными гранями. Элспгеит......... А1 Са FCy Со Ш Сторона кубич. ячейки в C.U........ 4,04 5,г:б 3,61 3,554 3,.54 Элемент.........Са Rli Pd Ag Се Сторона кубич. ячейки в 10 8 си........ 3,60 3,Ь2 3,15 -1,06 5,12 Элемент......... 1г Pt Au Pb Th Сторона кубич. ячейки Bl0-8c.vt........3,S0 3,03 4,OS 4,ill 5,04 2. По центрированному кубу. Элемент......... Li Na Cr FCaj д Сторона ячейки..... 3,50 4,30 2,89 2,88 Элемент.........Mo Та W К V Сторона ячейки..... 3,14 3,27 3,15 5,20 3,oi 3. Наиболее плотное расположение гексагональной системы. Элемент......... Be Mg Zn Cd Ti a............. 2,29 3.22 2,670 2.960 2,97 с............. 3,62 5,23 4,940 5.600 4,72 С/а............ 1,58 1,624 1,S60 1,890 1,59 Элемент......... Zr Се Co Ru Os a............. 3,23 3,65 2.514 2.686 2,714 с............. 5,14 3,96 4,110 4,272 4.320 С/а............ 1,59 U63 1,633 1,590 1,590 В последней табличке а обозначает размер ячейки по главной оси, с-по поперечной, с/а-отношение этих величин, равное отношению кристаллографии, осей. Элементы, относящиеся к одному столбцу периодич. системы, имеют вообще одинаковую структуру, наприм. одинаковое строение: 1) Li, Na, К, 2) Си, Ag, Au, 3) Zn, Cd, Ш и т. д. Наличие полиморфизма и другие причины вносят однако исключения в это простое правило. Элементы с металлоидным характером отличаются более слолсной структурой. Важно отметить углерод. Аллшз имеет строение, элементарный объем которого изображен на фиг. 4. Нейтральные атомы в этом объеме расположены в кольца по шести, и каждый атом тетраэдрически окружен четырьмя другими (тип молекулярной, или гомеополяр-ной, решетки). Графит-другой структуры, гексагональной, еще не определенной точно. Сажа (аморфный углерод, по прежним воззрениям) оказалась кристаллическим телом графитовой структуры. Галоидные щелочные металлы и окислы щелочноземельных металлов построены по типу каменной соли за исключением CsCl, в котором атомы цезия занимают вершины кубической ячейки, а атом хлора-ее центр. Исследование структур кристалла сложного состава показало, что расположение атомов в кристалле может быть лучше всего согласовано с координационной теорией Вернера.  Лит.: В у л ь ([) Р. В., Кристаллы, их образование, вид и строение, Москва, 1926; Бори М., Строение материи. П., 1922; И о ф ф е А. Ф., Физика кристаллов, М.-Л., 1929; Френкель Я., Электрическая теория твердых тел. Л., 1924; Брег г В., Введение в анализ кристаллов, перевод с англ., М.-Л., 1930; Born М., Atomtheorie des festen Zustandes, Lpz., 1923; E w a 1 d I. P., Der mechanische Aufbau des festen K6ri)trs in atomistischer Betracbtung, Miiller-Pouilkts Lehrbuch der Physik, B. 1, T. 2, 11 Auflage, Braunschweig, 1929; Groth P., Elemente d. physik. u. chem. Krvstallographie.Mch.-В., 1921. И. Мельников. КРИСТАЛЛИЗАЦИОННЫЕ АППАРАТЫ. Раз.пнча1от следующие важнейшие методы массовой кристаллизации (см.), применяемые в современной химической промышленности: 1) кристаллизация с удалением растворителя, 2) кристаллизация охлаждением насыщенных растворов, 3) кристаллизация с протекающими растворами, 4) холодные смесители и 5) кристаллизация в движении. 1. Крист^аллизация с удалением растворителя. Растворитель можно удалять или при помощи испарения его или при помощи перевода его в твердое состояние. Последний способ, способ вымораживания , выгодно применяется в большом масштабе при получении поваренной соли из морской воды в северных странах. Гораздо ббльшую область нрименения имеет первый способ.Испарение растворителя молено вести при t° выше и ниже точки кипения раствора. Медленное испарение в открытых чанах, чашах и бассейнах без нагревания часто практикуется, особенно когда имеют в виду получить крупные отчетливо образованные кристаллы. На практике таким образом кристаллизуют хромпик, медный купорос, нсел-тую кровяную соль и многие другие вещества. Для ускорения процесса применяется подогревание, чаще всего паром; ускорения кристаллизации достигают таюке устройством механической циркуляции воздуха над поверхностью испаряемого раствора. Простой открытый К. а. представляет чашу с баней, обогреваемой паром (фиг. 1). Удаление растворителя при кип. осуществляется в з-дской практике применением вакуум-аппаратов и выпарных аппаратов, позволяющих вести такое удаление с большой скоростью. Закрытые выпарные аппараты, применявшиеся ранее исключительно для целей сгущения, приспособляют в настоящее время и для кристаллизации. Главное затруднение,к-рое пришлось преодолеть при конструировании такого рода выпарных аппаратов, состоит в том, что выделяющаяся Иа охлаждение 0,100 кг воды от 90 до 20°...... 0,101 КВг 90 20°......  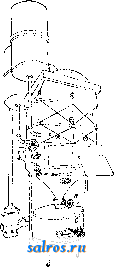 Фиг. 2. Теплота кристалллзации для 0,101-0,066 = 0,035 кг выделившегося КВг дна устраивают коническое, с большим углом наклона. Подобный аппарат показан на фиг. 2. Коническая нижняя часть аппарата а соединяется трубой с камерой б, служащей сборником для кристаллов. Соединяющая камеру труба имеет задвижку в, с помощью к-рой моншо от времени до времени разъеди- нять камеру и удалять * собравшиеся кристаллы. Существуют также другие типы выпарных аппаратов для одновременной кристаллизации; периодич. разгрузку стремятся устранить устройством барабанных фильтров и т. д. 2. Кристаллизация охлакдением насыщенных растворов. Насыщенные растворы, подвергаемые кристаллизации помощью охлаждения, получаются растворением сырого материала или сгущением слабых щелоков и только в редких случаях в результате химич. превращений. Охлаждение молеет осуществляться естественным образом при помощи наружного воздуха или искусственно движущегося воздуха, водою или искусственными смесями, а также и в вакууме. В тех случаях, когда желают получить крупные кристаллы, следует избегать быстрого начального охлаждения, при к-ром может наступить мелкая кристаллизация. Это достигается или предварительным подогревом сосудов или нагреванием раствора выше t° насыщения; в последнем случае раствор обогревает сосуды, и преждевременная кристаллизация не будет иметь места. При охлаждении приходится отводить тепло для приведения раствора к желаемой температуре, причем отводится и выделяющаяся теплота кристаллизации. Пример: насыщенный раствор КВг поступает на кристаллизацию при 90°; такой раствор содержит в 100 г воды около 101 г КВг. Если раствор охлаждается до 20°, в 100 г его остается 66 8 КВг и выкристаллизовывается 101 - 66 = 35 3 КВг. Принимая теплоемкость КВг = 0,113, воды равной 1,0, теплоту кристаллизации равной 42 Cal на 1 кг КВг, находим количество отводимого тепла: .............. 0,1х1,0х(90-20) = 7,0 Cal . . 0,101x0,113x(90-20) = 0,8 Cal . . 0,035X42= 1,47 Cal Всего на 0,035 кг КВг или па 1 кг . . , 9,27 0,035 9,27Са1 = 265 Cal кристаллич. масса загрязняет нагревательные поверхности и части аппаратов, особенно трубы. Для устранения этого явления предложено устройство отдельных сборных резервуаров для собирания кристаллов. Для того чтобы осадок не накоплялся на вертикальных трубах, аппараты строятся с сильной циркуляцией; вместо плоского Если для охлаждения применять воду и разность t° между нею и раствором поддерживать в 5° (именно в начале 90° - 5° = 85° и й'конце 20° -5° = 15°, то на канедый кг со- ли потребуется ~ =53л охлаждающей воды. Криста-ллизация охлаждением горячих насыщенных растворов идет много успешнее в вакуум-аппаратах, причем как теплота жидкости, так и теплота кристаллизации здесь расходуются на обращение части жидкости в пар, что в значительной степени ускоряет процесс. Во многих стучаях довольствуются естественным охлаждением наружным воздухом, напр. при кристаллизации содовых щелоков [1], а также растворов KCIO3. Для кристаллизации KCIO3 применяются чугунные баки, с внутренней поверхности обшитые оловян. листами или покрытые эмалью, длиною 1 800 лш, шириной 1 200 мм, глубиною 750 мм с передней стороны и 600 мм с задней. Каждый такой бак дает до 125--150 кг кристаллов при стоянии раствора в течение 8 суток летом и 1А-зимой. Подобные же установки применяются в Карлсбаде при кристаллизации предварительно упаренной воды карлсбадского источника. Иногда для ускорения процесса кристаллизации в баки ставят тонкостенные металлич. ящики-ячейки, помещаемые последовательно внутри раствора и охлаждаемые проточной водой. На этом принципе устроены например аппараты Г. Шихта [2]. Вообще необходимо отметить, что описываемый метод кристаллизации, ранее один из наиболее распространенных в химич. практике, постепенно вытесняется другими, более совершенными. 3. Кристаллизация с протекающими р а с ТВ о р а м и. В кристал.тизаци-онных баках кристаллы и раствор находятся в покое, и выравнивание убывающего около кристаллов насыщения идет только путем диффузии. Бокк первый предложил способ выращивания кристаллов как на дне, так и на стенках сосуда при движении щелоков по неподвижным наклонным поверхностям; в этих условиях получается возможность питать кристаллы и увеличивать их размеры до той величгшы, которая достигается в непо-двилшых баках. Качество и форма кристаллов зависят в сильной стенени от температурных условий, при к-рых протекает кристаллизация; выделяющиеся вначале при высокой t° кристаллы имеют совсем иной характер, чем те, которые получаются в конце процесса, когда t° сильно понижается. В желобах Бокка легко поддерживать температурные границы, необходимые для равномерной кристаллизации, и они нашли себе применение для многих случаев, например для кристаллизации растворов буры, причем в пределах от 60 до 35° получаются прекрасные друзы длинных кристаллов. После Бокка рядом изобретателей были предложены различные системы, основной идеей к-рых было создание неглубоких потоков, непрерывно протекающих по плоским поверхностям. На фиг. 3 показана в боковом разрезе и сверху установка Emil Passburg для кристаллизации растворов хлористого калия. Две громадные сковороды, сделанные из котельного железа, для ежедневной переработки 600-700 м^ раствора дают --100 ООО кг соли. Почти насыщенный раствор с f°=90- 95° поступает на сковороду через конец а и медленно движется по сковородам, имеющим при ширине 4 м длину ок. 50 м. Сковороды помещены ца бетонных каналах Ъ, по которым, как показано стрелками, зигзагообразно протекает охлаждающая вода. КроТ. Э. т. XI. ме нижнего охлалсдения водой производится еще охлаждение с поверхности продуванием воздуха; с этой целью устраивается над сковородами крыша с и тяговая труба d. Выпадающая соль переносится по жолобу / скреб- е  Фиг. 3. ковым конвейвро.ч (см.) со скребками е на наклонную плоскость д, где находится короткое время для обратного стока маточного раствора, и оттуда подъемником переносится на транспортер h. Транспортирующие устройства f и h обслуживаются гидравлической установкой, показанной с правой стороны фигуры. Сравнительно долгое пребывание соли на сковородах и тщательное перемешивание дают возмолсность получать крупнокристаллич. материал. На принципе медленного движения криста.ялизующегося раствора построены многочисленные аппараты. Зауербрей сконструировал аппарат [*] в форме башни, в к-рой раствор, стекая сверху но перегородкам внутри башни, сталкивается с встречным током атмосферного воздуха, служащего для охлаждения. Такой аппарат имеет преимущество в смысле экономии места. Интересны аппараты, предлолеенные Васковским основанные на распылении кристаллизующегося раствора. 4.Холодные смесители.В тех случаях, когда не стремятся получить кристаллическую массу непременно в крупных кристаллах или когда выделенная мелкокристал-лич. масса должна подвергнуться вторичной кристаллизации, удобно применять такие аппараты, в которых одновременно с охлаждением насыщенные растворы подвергаются энергичному перемешиванию, благодаря чему происходит быстрая отдача тепла охлаждающей поверхности. В зависимости от скорости движения жидкости находится величина выпадающих кристаллов. Для того чтобы оседающая на дне и боковых поверхностях кристаллич. масса не стесняла действия мешалки, последняя снабжается в таких аппаратах особыми скребками или металлическими щетками. На фиг. 4 Показано внутреннее устройство подобн. аппарата, сконструированного машинной фабрикой Е. Passburg в Берлине. Крепкий вал а, приводимый в движение с помощью зубчатой передачи, вращается в двух подшипниках b и с, поме- щенных сверху и в крышке аппарата. Особая подвесная тарелка защищает жидкость от загрязнения смазочными маслами. Лопасти меша.гнш д снаблеены щетками е, очищающими поверхность от нарастающих кристаллов. Между двойными стенками аппарата циркулирует охлаждающая вода. Вместо закрытого охлаждающего кожуха часто устраивают внешнее орошение поверхности и аппарат помещают тогда над сборником стекающей воды. Для той же цели быстрого охлаждения и смешивания применяют аппараты и др.конструкций, наприм. подобные выпарному типа Chenailler (фиг. 5). Через полые линзы L этого аппарата, которыми производится перемешивание, протекает охлаждающая вода. На фиг. 6 изобранеена кристаллизационная 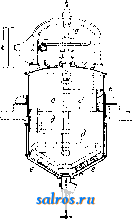 Фиг. 4.  установка для приготовления искусственного меда. Сахар растворяют в воде в котле а с паровым подогревом и раствор пропускают в инверсионный котел Ь, где сахар инвертируется с помощью к-ты. По окончании инверсии раствор переводится в кристал.тиза-ционные котлы с, где ох.таждается до 20°. После прибавления к охланаденному раствору твердого искусственного меда, полученного от предыдущей операции, все тщательно перемешивают; прибавка инвертированного сахара способствует кристаллизации сиропа; готовая кристаллич. кашица поступает в упаковочные машины d. Подобные, но несколько более сло-неные установки применяются в очень многих случаях, например при кристаллизации в вакууме тринитрофенола и т. п. Во многих случаях охлалодения водой бывает недостаточно и приходится применять повторное более си.тьное охлаждение. На 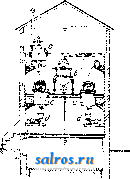 Фиг. 6. фиг. 7 показана установка для повторной кристаллизации берто.тетовой соли. 3 ООО кз щелока с Г+ 20° охлаждают здесь до -10°, чем достигается выпадение еще 200 кг KCIO3. В компрессоре А компримируется аммиак до 8 а fm и затем в змеевиковом конденсаторе В он сгущается при охлаждении водой до 15°. Жидкий аммиак направляется через регулирующий вентиль в змеевик С кристаллизатора D, в котором испаряется, причем отнимает от щелока тепло в количестве ок. 6 ООО Cal в час. Испарившийся газ трубопроводом Е снова направляется в компрессор. Выпадающая в кристаллизаторе масса собирается в конусообразной нижней части аппарата и оттуда через вентиль G направляется в нучи М. Для уменьшения большого расхода холода охлажденный в аппарате D щелок перекачивают через центробежный кристаллизатор Н в холодильную рубашку второго кристаллизатора I, служащего для предварительного охлаждения первоначального раствора. Последний поступает во второй кристаллизатор сверху через канал К и течет противотоком относительно охлаждающего рубашку щелока. Темп-ра входящего во BTopOii кристаллизатор охлаждающего щелока изменяется от -10 до+ 5°, в то время как t° поступающего первоначального раствора-от +20 до +5°. Выпадающая во втором кристаллизаторе кристаллич. масса таклсе направляется через вентиль L в нучи М. 5. К р и с т а л л и за ц и я в движении. Примером такого рода кристаллизации мо-лсет слунеить операция выпаривания растворителя под вакуумом при Здесь растущие кристаллы находятся в непрерывном движении в среде питающего их раствора (см. Сахарное производство). Рассмотрим случай применения этого метода не при кипении, а при охлаледении раствора. Аппаратура, применяемая при этом, довольно разнообразна; аппараты строят как открытые, так и закрытые; иногда применяют вакуум. 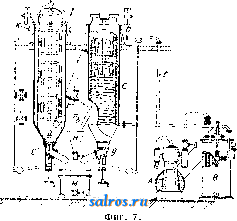 В закрытых цилиндрической формы резервуарах для перемешивания применяют винтовые меша.аки или винтовые шнеки. Целесообразная форма открытого аппарата, предложенного Бокком, так наз. кристаллизационная лю.лька, изображена на фиг. 8. Установка из трех таких аппаратов показана на фиг. 9. Горячий насыщенный раствор из сборного ящика а непрерывно поступает в аппараты- люльки Ь. Щелок с кристаллами двилсется вдоль по качающимся люлькам и готовые кристаллы вместе с маточным раствором поступают в скребковый транспортер с, к-рый подает кристаллы в сборный ящик d. Из последнего ковшевым прибором е кристаллы отделяют от маточного раствора и переносят в вагонетки /. Описанный аппарат с успехом применяют для кристаллизации хромата калия, глауберовой соли, соды, гипосульфита натрия.  Фиг. 8. ем растворителя прп постоянной t°-обычно на водяной бане или под вакуумом-и применяется для веществ, растворимость к-рых не сильно изменяется с 3) К. п р и п о-нижении растворимости добавкой постороннего вещества достигается одним из двух путей: а) смещением ионного равновесия в растворе введением избытха одного из ионов (напр. К, при очищении NaCl достигается добавлением крепкой НС1 к насыщенному раствору хлористого натрия), б) изменением природы растворителя (например К. из водных растворов при добавлении к ним спирта). Получению вещества в чистом виде при К. препятствуют следующие обстоятельства: 1) образование смешанных кристаллов, т. е. твердых растворов (в особенности же двух изоморфных  Фиг. 9. а таклее фуксина, азотнокислого аммония, медного купороса, лимонной кислоты и т. п. Вообще метод кристаллизации в движении получает все большее распространение в химич. практике. Лит.: L U п g е О., Handbuch d. Sodaindustrie u. ihre Nebenzweige, B. 3, a Aufl., p. 116, 596,Brschw., 1909; ) r. П. 182299 (1905); ) Г. П. 112990 (1899); *) Г. П. 257685 (1913); ) Г. П. 306173 (1914); Ullm. Enz., B. 7, В.-W., 1919. H. Масленников. КРИСТАЛЛИЗАЦИЯ, процесс выделения твердой фазы в виле кристаллов (см.) ири затвердевании вещества в жидком состоянии (из расплава) или при выде.тении растворенного вещества из раствора. К. является одним из важнейших способов получения веществ в чистом виде (разделения компонентов раствора); о К. в технике см. Кри-сталлизациопные аппараты. Из раз.чичных методов К, укажем на три основных. 1)Использование зависимости растворимости от t°. Растворимость часто сильно возрастаете t°; при охлаждении насыщенного раствора выкристаллизовывается некоторое количество вещества, определяемое по кривой растворимости; при этом иногда этот избыток вещества не выкристаллизовывается - раствор остается пересыщенным-до тех пор, пока не будет введена затравка -кристаллик того же или изоморфного с ним вещества. К. из пересыщенного раствора используется также для получения желаемой формы кристаллов. Так, Na2Cr04 кристаллизуется из пересыщенного раствора в виде Naj,Cr04- ЮНзО введением в качестве затравки кристаллика Na2SO4-10H2O; чтобы не внести при этом загрязнений, К. возбуждают сначала в отдельной пробе раствора--в пробирке-и затем, выбрав чистый кристаллик Na2Cr04, за-травляют им общую массу раствора. 2) И з о-термическая К. достигается испарени- веществ, что препятствует их разделению), 2) одновременная К. примесей--загрязнений; от нее освобождаются фракционной К., и 3) в кристаллах часто образуются включения маточного раствора, благодаря чему вводятся все остающиеся в нем загрязнения. Многочисленными включениями раствора объясняется непрозрачность кристаллов поваренной соли и их сильная растрес-киваемость при нагревании; кроме того мелсду кристалликами всегда задерживается растворитель. Для отделения от загрязняющей жидкости кристаллы измельчают, отмывая на фильтре (отсасывая под уменьшенным давлением) или при помощи центрифугирования. Наиболее надежный способ высушивания кристаллов-сплавление, но оно может применяться лишь для веществ, не содержащих кристаллизационной воды (например AgNOs, KNO3). Скорость К. При К. из переохлажденного расплава или из раствора она происходит с некоторой скоростью V, зависящей прежде всего от темп-ры процесса. В виду трудностей определения скорости роста каждой данной грани (зависящей от характера грани) определяют обычно суммарную, так наз. линейную скорость К., находимую как скорость перемещения резкой видимой границы кристаллов и жидкой фазы в одном из колен U-образной трубки, причем К. вызывают введением кристаллика-затравки в другое колено. При этом i; для разных веществ и при разных условиях меняется от нескольких мм/м до 500 мм/м и более. С понилсением температуры ниже точки плавления, ДТ = Т. ,г. - Т (см. фиг,),и, вначале равная О, быстро растет, затем остается в некотором i°-HOM интервале постоянной (достигнув наибольшей величины) и при дальнейшем охлаждении нормалыю убывает с Г,  как скорость любого молекулярного процесса. По Тамману, повышение скорости К. при понижении t°, близкой к t° (при малых АТ), определяется отводом выделяю-шейся скрытой теплоты К. При малых АТ скорость теплоотдачи мала и на гранях образующихся кристаллов t° равна t°nji., что и затрудняет К. Скорость К., как показали Марк и Т„ йТ понижение t ниже Vrn- фреЙНДЛИХ, ЧрвЗ- вычайно резко понижается в присутствии посторонних примесей, в особенности примесей поверхностноактивных веществ, адсорбирующихся на гранях с понилгением их поверхностного натянеения(см. Капиллярные явления, Жидкости, Адсорбция) и тем препятствующих их росту. Условия К., кроме скорости v, определяются еще и скоростью образования центров К., т. е. числом N центров К., образующихся за единицу времени в единице объема; от этих центров начинается К. в жидкости и идет тем быстрее, чем больше N. Тамман показал, что зависимость N от t° (от переохлаждения АТ) определяется кривой, изображенной на фиг. Относительное расположение кривых V и N определяет все условия К. Так, если максимум N (а-кривая) лежит в области больших v, переохлаждение жидкости достигается с трудом; наоборот, тело легко получается в переохлажденном (стекловидном, аморфном) состоянии, если максимум N (3-кривая) лежит в области более низких темп-р, где v весьма мала; расстек-ловывание, т. е. К., в таких телах происходит очень медленно из-за огромной вязкости. Если значения N велики (а-кривая), то тело кристаллизуется в агрегат весьма мелких кристаллов (у многих металлов). При малых N, К. распространяется из одного или немногих центров и образуется крупнокристаллический агрегат или монокристалл. Лит.: Обреимов И. В., Состояние вещества, П., 1921; Richards Т. W.. Kristallisieren, Handb. d. Arbeitsmethoden in d. anorgan. Chemie, hrsg. v. A. Stabler, B. 2, H. 1, p. 378, В., 1919; Tammann G., Kristallisieren u. Schmelzen, Lpz., 190 3; F r e u n d-lich H., Kapillarchemie, 3 Auflage, Leipzig. 1923; M a г с R., Vorlesungen iiber chemische Gleichgewichts-lehre u. ihre Anwendung auf d. Probleme d. Minera-logie, Petrographie u. Geologie, Jena, 1911; Ztschr. fiir physikalische Chemie ,Leipzig, 1908, B. 61, p. 385, 1 90 9, B. 6 7, p. 4 70, B. 6 8, p. 104, 1910, B. 73, p. 6 85; Tammann G., Lehrbuch d. Metallographie, 3 Auflage, Leipzig, 1923; G e г n e z, CR , 1882, v. 95, p. 1278; Kurnakow N. und Zemczuznyi, eZtschr. fiir anorg. Chemie , Hamburg-Lpz., 1907, B. 52, p. 186. П. Рвбиндер. КРИСТАЛЛИЧЕСКАЯ СТРУКТУРА, см. Кристаллография. КРИСТАЛЛОГРАФИЯ, наука, занимающаяся изучением кристаллов. Исторически связана с минералогией и раньше составляла как бы ее часть. С середины 19 в., и особенно за последние 30-40 лет, стала самостоятельной дисциплиной. Впервые классификация кристаллов была дана Гесселем (в 1830 г.) и независимо Гадолином (в 1868 году), который вывел основные 32 класса кристаллов. В дальнейшем, благодаря открытому Федоровым в 1885 г. закону выполнения пространства, стала возможной естественная классификация кристаллов. Этим законом Федоров в самой общей форме решил вопрос о всех возможных случаях выполнения пространства многогранниками. Такое выполнение возможно четырьмя способами:кубами (тр и-параллелоэдрами) кубооктаэдрами (гептапараллелоэдрами), додекаэдрами (гексапараллелоэдрами) и призмами (тетрапараллелоэдра-м и), а также деформированием этих основных многогранников-параллелоэдров. Когда была решена эта задача, явилась возможность применить чисто математические положения к кристаллам. Если мыслить кристалл состоящим из многогранников, то мы должны представить, что он может быть составлен из додекаэдров, кубов, октаэдров, призм и их деформаций. Кристаллы м. б. четырех родов (четырех структур): кубической, додекаэдри-ческой, октаэдрической и призматической.В свою очередь эти структуры делятся на два типа: кубический и гипогексагональный. Кристаллы, обладающие призмат. структурой, относятся к гипогексагональному типу, а кристаллы других структур-к кубич. типу (основанием такого разделения служит расположение элементов симметрии, а следовательно п пространственное расположение граней). Различие структур в кристаллах кубич. типа определяется плотностью граней (порядком наибольшего постоянства граней). Кубические кристаллы делятся на тетрагонало-идные (кубическая, квадратная, ромбическая, моноклинная и триклинная сингонии) и тригоналоидные (тригональная, моноклинная и триклинная сингонии). Гипогексаго-нальные кристаллы обнимают все гексагона-лоидные кристаллы (гексагональная, ромби-ческ., моноклинная и триклинная сингонии). Понятие класс теперь играет совершенно другую роль: кристаллы моноклинные, триклинные и т. д. могут быть различных структур. И не эти классы определяют место кристалла в естественной классификации. Все классы должны теперь производиться деформированием основных параллелоэдров. Напр., если возьмем куб и будем его растягивать по четверной оси, то получим квадратную сингонию; если же куб деформируем в одной плоскости, будем иметь моиоклинную сингонию, и т. д. К. делится на геометрическую, физическую и химическую. Геометрическая К. занимается изучением внешней формы и внутреннего строения кристалла, а также тех законов, которым эта форма подчиняется. Ее можно разделить на теоретическую и экспериментальную. Обе вместе они обнимают учение о структуре, получившее в самое последнее время исключительное практич. значение. Это объясняется тем, что многие материалы-строительные и технич. камни, металлы-представляют собой б. или м. правильно построенные агрегаты кристаллов весьма разнообразной величины, от довольно крупных до субмикроскопических. Знание свойств отдельных составляющих их величин, взаимного расположения и связи между собой чрезвычайно важно для определения технич. свойств материала. Геометрич. К. имеет свою методику. довольно разнообразную и доведенную до высокой стенени точности. Она заключается в технике выращивания, измерения и вычисления кристаллов, а также и в довольно сложной работе структурного исследования. И с кус с ТВ е иное выращивание кристаллов проводится либо в обычных кристаллизаторах либо в термостатах. Особый случай представляет получение больших металлич. монокристаллов, для чего применяются частотные электрич. печи. Учение о симметрии и формах криста.тлов. Кристаллы имеют форму симметричных многогранников, к-рые в зависимости от элементов симметрии--плоскостей симметрии, поворотных и зеркально поворотных осей симметрии, в них присутствующих, делятся на 32 вида симметрии. Плоскостью симметрии называется плоскость, делящая многогранник на тождественно равные части. Поворотной осью называется прямая, поворотом вокруг которой тело совмещается со своим начальн. положением в пространстве. В зависимости от числа совмещений кристалла со своим начальным положением при обороте вокруг оси на 360° различают поворотные оси двойные,тройные, четверные и шестерные. Зеркально поворотной осью называется такая ось, вокруг к-рой надо повернуть фигуру, а затем отразить в плоскости, к ней перпендикулярной, чтобы фигура совместилась со своим начальным положением. 32 вида симметрии в свою очередь группируются в 6 сингоний (систем): триклинную, моноклинную, ромбическую, тетрагональную, гексагональную и кубическую (см. фиг.). 1) Триклинная сингония имеет 2 вида симметрии. Простые формы (многогранники, у к-рых все грани выводятся из одной заданной при помощи элементов симметрии этих многогранников), в ней встречающиеся: моноэдр 1 и нинакоид 2. Кристаллы триклин. сингоний представляют собой комбинацию (многогранники, у к-рых не все грани выводятся из одной заданной) этих простых форм. Пример-кристалл медного купороса 3, представляющий комбинацию 6 пинакоидов. 2) Моноклинная сингония имеет 3 вида симметрии; простые формы, в ней наблюдаемые: моноэдр, пииакоид, диэдр 4 и ромбич. призма 5. Кристалл гипса 6 представляет комбинацию пинакоида в и двух призм аиб. 3) Ромбическая сингония имеет 3 вида симметрии; простые формы ее: моноэдр, нинакоид, диэдр, ромбическая призма, ромбич. пирамида 7, ромбич. дипирамида 8, ромбич. тетраэдр 9. Кристалл эпсомита 7 0 иллюстрирует комбинацию ромбического тетраэдра а, ромбич. призмы б и пинакоида в. В этих трех сингониях нет осей симметрии выше двойной поворотной. 4) Тетрагональная сингония дмеет 7 видов симметрии, в к-рых всегда присутствует одна четверная поворотная или зеркально поворотная ось кроме двойных и плоскостей симметрии. Простые формы ее: моноэдр, нинакоид, тетрагональный тетраэдр 77, тетрагональная призма 12, тетрагональная пирамида 13, тетрагональная дипирамида 14, дитетрагональная пирамида 15, дитетрагональная призма 16, дитетрагональная дипирамида 17, тетрагональный трапецоэдр 18, тетрагональный скаленоэдр 19. Кристалл оловянного камня 20 образован тетрагональной динирамидой а и двумя тетрагональными призмами бив. 5) Г е к с а г о н а л ь-ная сингония имеет 12 видов симметрии; характерно для нее присутствие одной тройной или одной шестерной поворотной или зеркально поворотной оси симметрии кроме двойных и плоскостей симметрии. Простые формы ее: моноэдр, нинакоид, тригональ-ная пирамида 21, тригональная призма 22, тригональ-ная дипирамида 23, дитригональная пирамида 24, дитригональная призма 25, дитригональная дипирамида 26, тригональный трапецоэдр 27, ромбоэдр 28, дитригональный скаленоэдр 29, гексагональная пирамида 30, гексагональная призма 31, гексагональная дипирамида 32, дигексагональная пирамида 33, ди-гексагопальная призма 34, дигексагональная дипи- рамида 35, гексагональный трапецоэдр 36. 1?ристалл берилла 37-комбинация призмы а, дипирамиды б и пинакоида е. 6) Кубическая сингония имеет 5 видов симметрии, причем в каждом из них боль-Hie одной тройной пли четверной оси кроме двойных и плоскостей симметрии. Простые формы ее: тетраэдр 38, тригонтритетраздр 39, тетрагонтритетра-эдр 40, пентагонтритетраэдр 41, гексатетраэдр 42, гексаэдр 43, тетрагексаэдр i/rf, ромбододекаэдр 45, пента-гоиальный додекаэдр 46, дидодекаэдр 47, октаэдр 48, тригонтриоктаэдр 49, тетрагонтриоктаэдр 50, гексок-таэдр 51, пентагонтриоктаэдр 52. Кристалл пирита 53-комбинация пентагондодекаэдра я, октаэдра б и додекаэдра в. Всего простых форм в К. 47. Измерение ведется обьгано на особых приборах - гониометрах. Для точных работ применяются т. и. отражательные гониометры, основанные на следующем принципе. Иа кристалл падает параллельный пучок лучей и отражается от одной из его граней в трубу, установленную на бесконечность; иолол-сение кристалла, к-рый при этом помещен на особом вращающемся столике с лимбом, отмечается на нониусах. Поворотом столика на место первой грани приводится другая; положение ее также отмечается на нониусах и разница в отсчетах даст угол между нормалями к обеим граням. Построенные по этому типу приборы назьша-ются однокружпыми; они обыкновенно дают точность до 1 или 30 . Есть и специальные гониометры, предназначенные для исключительно точных работ, напр. для измерения изменений углов в зависимости от темп-ры, которые дают точность до 2 . Измерение на однокружных гониометрах дает весьма точные результаты, но оно весьма кропотливо, так как требует неоднократной переклейки кристалла. Кроме того эти результаты гораздо труднее поддаются вычислительной обработке, чем при другол!, т. наз. теодолитном, методе. Этот последний с каждым годом приобретает все большее и большее распространение. В теодолитном гониометре имеются не один, а два круга с делениями. Путем такого же отражения, как на однокрулном гониометре, отмечают положение каждой грани кристалла при помощи двух сферич. координат-долготы и полярного расстояния. Теодолитные гониометры существуют различных систем и разной степени точности. Лучшими моделями можно считать гониометры Гольдшмита и Федорова. Д.тя грубых измерений служат прикладные гониометры, дающие точность не выше /2°. Они применяются для больших объектов, в несколько см величиной, к-рые не могут быть измерены на отракательных гониометрах. Результаты измерения подвергаются в ы-числительной обработке, имеющей целью дать геометрические константы решетки исстедуемого вещества, т. е. осевые углы, осевые единицы и символы найденных на кристаллах форм. Вычисление сопровождается черчением проекции, к-рая суммирует наблюдения над отдельными кристаллами и, устраняя все случайные факторы, дает пред-став.тение об идеальном развитии наблюдаемой комбинации. Из весьма многочисленных видов проекции в К. применяются гл. обр. стереографическая, гномоническая и ортогональная. Вычисление молено вести либо пользуясь формулами сферической тригонометрии либо графически. В первом случае получаются совершенно точные величины, по вычисления отнимают много времени. Графич. метод хорош исключительной быстротой, конечно в ущерб точности. Он бывает динаты атомов различных элементов, входящих в состав исследуемого вещества. Это дает возмоленость точно установить его решет-  особенно прост и нагляден, если применять сетки (стереографич. или гномонические). Наиболее рационально построенной является сетка проф. Вульфа, имеющая 0 20 см и позволяющая работать с точностью до 15. Гониометрич. исследование дополняется исследованием структуры, к-рое м.б. проведено лишь при помогци рентгеновских лучей (см. Кристалл). Соединенным исследованием но методам Лауе, Дебая-Шерре-ра и снимками с вращающегося кристалла можно определить пространственные коор- ку и построить структурную модель. Результаты не всегда получаются в виде однозначного решения; это зависит от большей или меньшей сложности химического состава и от пространственной группы, к которой м. б. отнесено вещество. Физическ. К. занимается изучением оптич., термич., электрич. и магнитных свойств кристаллов. Наиболее разработанной главой ее является кристаллооптика, имеющая ишрокое практическ. применение при исследовании минералов и горных пород. Это ис- следование ведется при помощи специально для этой цели ностроенного поляризационного микроскопа. В настоящее время это весьма совершенный измерительный прибор, дающий возможность определять все важнейшие оптич. константы исследуемого кристалла (см. Поляризационные приборы). Для более точного определения показателей преломления служат рефрактометры (см.), где измерение основано на принципе полного внутреннего отражения. Еще более точные результаты дает хороший однокружный гониометр; применение его однако ограничивается тем, что объект должен иметь хорошие естественные или искусственные отшлифованные грани, составляющие призму с углом ок. 60° и ребро к-рой точно ориентировано. Изготовление таких ориентированных призм и шлифов составляет важную часть кристаллографии, методики и имеет большое технич. значение (поляризационные приборы; сахариметры; оптич. пирометры, кварцевые спектрографы и др.). Из других упомянутых физич. свойств технически важны электрич. свойства кристаллов. Эти свойства выражаются в том, что нек-рые кристаллы при нагревании и, обратно, при охлаждении электризуются (пироэлектричество). Из них диэлектрики могут чрезвычайно долго удерживать на своей поверхности заряд. Аналогичное явление происходит и при сдавливании или растягивании кристалла (пьезоэлектрич. явления). Обратный эффект заключается в том, что внесенный в электрич. поле кристалл претерпевает деформацию-сжимается или расширяется. Эти свойства кристаллов в последнее время широко использованы в радиотехнике, где в качестве пьезокристаллов применяются гл. обр. кварцы. Механические свойства кристаллов. Спайность, И.ЧИ способность кристалла колоться по определенным плоскостям, различают трех степеней: спайность весьма совершенную, напр. кристалл слюды делится на тончайшие листки; соверше н-ную, напр. кристалл кальцита при ударе распадается на кусочки-ромбоэдры с плоскими гранями; несовершенную-при ударе получается излом, ровных плоскостей нет. Твердость кристаллов различных веществ различна. Наиболее просто определять твердость при помощи шкалы Моса, содержащей 10 эталонов твердости. За эталоны приняты: тальк (тв. 1), гипс (тв. 2), кальцит (тв. 3), флюорит (тв. 4), апатит (тв. 5), ортоклаз (тв. 6), кварц (тв. 7), топаз (тв. 8), корунд (тв. 9) и алмаз (тв. 10). Механич. сдвиги происходят в кристаллах под влиянием одностороннего давления. Напр. при ковке, прокатке, вальцовке металлов мелкие кристаллы их располагаются так, что свойственные им плоскости скольжения идут парал.т1ельно плоскости ковки и т. д. Из тепловых свойств кристаллов упомянем теплопроводность и способность кристаллов расширяться от нагревания. Опытным путем установлено, что: 1) теплопроводность кристаллов по плоскостям спайности больше, чем по паправлениям, к ним перпендикулярным, и 2) кристаллы по разным направлениям имеют разные коэфи-пиенты расширения. Химическая К. занимается изучением связи между внешней формой кристалла и его химич. составом. Сюда относятся явления полиморфизма, изоморфизма, изучение количественного распределения всех исследованных до сих пор кристаллических веществ по системам и пр. Одной из интереснейших и практически важных глав химич. К. является кристаллохимии ее кий анализ. Этот метод, созданный Федоровым, имеет целью заменить химич. анализ гораздо более быстрым кристаллографич. исследованием. Метод этот имеет конечно свои недостатки, заключающиеся главн. образ, в невозможности определять кристаллы, принадлежащие к кубической системе, и в нек-рой трудности усвоения метода. В последние годы проф. А. К. Болдыревым (Ленинград) сделана интересная попытка упростить метод Федорова и сделать его доступным каждому рядовому химику. Лит.: Геометрическая К.: Артемьев Д. Н., Кристаллография, ч. 1-4, Берлин, 1923; В у л ь ф Г. В., Основы кристаллографии, М.-Л., 1926. - Физическая К.: Грот П., Физич. кристаллография и введение к изучению кристаллографических свойств важнейших соединений, перевод с немецкого, СПБ, 1897; Иоффе А. Ф., Физика кристаллов, М.-Л., 1929; Белянкин Д. С, Кристаллооптика, Л., 1928; V о i g t W., Lehrbuch d. Kri-stallphyslk, Leipzig, 1928; P о с к e I s F., Lelubuch d. KristaUoptik, Lpz. - В., 1906.-X и м и ч e с к a я К.: Ф е д о р о в е. С, Кристаллохимический анализ на примерах, Новые идеи в химии , СПБ, 1914, сборн..5; G г о t h P., Elemente d. physik. u. chem. Kristal-lographie, Leipzig, 1906-1919; F e d о r о f f W. E., Das Kristallreich, Записки Российской академии наук , т. 36,серия 8,П., 1920.-М е т о д и к а исследования (измерение и вычисление): Tutton А. е.. Crystallography а. Practical Crystal Measurement, 2 ed., v. 1-2, London, 1922; Barker T. V., Graphical a. Tabular Methods in Crystallography as the Foundation of a New System of Practice, L., 1922; GossnerB., Kristallberechnungu. Zeichnung, Lpz., 1914.-P ентгенометрия и исследование структуры: NiggliP., Kristallographi-sche u. strukturtheoretische Grundhegriffe, Leipzig, 1928; G I 0 с к e r R., MaterialprOfung in Rontgenstrahlen, В., 1927; Schleede A. u. Schneider E., Rontgenspectroscopie u. Kristallostrukturanalyse, B. 1-2, Lpz., 1928; О t t H., Strukturbestimmung mit Rontgeninterferenzen, Leipzig, 1928; Herzfeld K., Glttertheorie d. festen Korper, Lpz., 1928.-Исторический обзор развития К.: Вернадский В. И., Основы кристаллографии, ч. 1, вьш. 1, СПБ, 1903; Baumhauer Н., Die neue Entwick-iung d. Kristallographie, Brschw., 1905. E. Флинт. КРИТИЧЕСКИЕ ТОЧКИ в металлургии, температуры, при которых происходят задержки или изменения скорости процесса охлал-сдения или нагревания металлов и их сплавов. Каждая К. т. соответствует какому-нибудь превращению вещества, идущему с тепловым эффектом, нарушающим правильный ход охлаждения. Иногда превращения (нонвариантные) совершаются при одной определенной темп-ре-в этом случае получается одна К. т. (задержка охлаждения). Иногда же превращения (диварпантные, моновари-антныо) происходят в пек-ром температурном интервале-тогда получаются две или несколько критических точек (изменения скорости охлал-сдения). Сообразно с характером превращений все К. т. мол-сно разделить на следующие группы. 1) Агрегатные К. т. соответствуют переходу вещества из жидкого состояния в твердое; например точки застывания чистых металлов, нача.яа и конца застывания сплавов, эвтектические и перитектические точки. 2) А л л о т р о и и ч е с к и е К. т. отвеча- 1 ... 28 29 30 31 32 33 34 ... 49 |
|||||||||||||||||||||
|
© 2007 SALROS.RU
ПромСтройМат |